题目内容
1.一定条件下,在密闭恒容的容器中,发生如下反应:3A(g)+2B(g)+6C(g)$\frac{\underline{\;高温\;}}{\;}$M(s)+12N (g),不能表示上述反应达到化学平衡状态的是( )| A. | 3v逆(B)=v正(C) | B. | 容器内压强不再改变 | ||
| C. | 混合气体密度保持不变 | D. | c(B):c(C):c(N)=1:3:6 |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、3v逆(B)=v逆(C)=v正(C),达平衡状态,故A正确;
B、容器内压强不再改变,说明气体的物质的量不变,反应达平衡状态,故B正确;
C、混合气体密度保持不变,说明固体的质量不变,说明反应达平衡状态,故C正确;
D、当体系达平衡状态时,c(B):c(C):c(N)可能是1:3:6,也可能不是1:3:6,与各物质的初始浓度及转化率有关,故D错误;
故选D.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
11.有一瓶无色气体,可能含有H2S、CO2、HBr、HCl、SO2中的一种或几种.向其中加入过量氯水,得到无色透明溶液,把溶液分成两份;向其中加入盐酸化的BaCl2溶液,出现白色沉淀;向另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀.则下列结论正确的是( )
| A. | 原气体中肯定有SO2,可能有HCl | B. | 原气体中肯定没有H2S、HBr和CO2 | ||
| C. | 原气体中肯定有SO2和 HCl | D. | 原气体中肯定没有CO2 |
12.下列除去杂质(括号中的物质为杂质)的方法中,不正确的是( )
| A. | NH3气体(H2O):通过浓H2SO4干燥 | |
| B. | FeCl2溶液(FeCl3):加入铁粉,过滤 | |
| C. | CO气体(CO2):通过NaOH溶液洗气后干燥 | |
| D. | Cl2气体(HCl):通过饱和NaCl溶液洗气后干燥 |
9.用如图所示装置进行下列实验,所选的药品、现象和结论正确的一组是( )
| 选项 | a | b | c | 现象 | 结论 | 装置 |
| A | 稀盐酸 | 大理石 | Na2SiO3溶液 | c中有白色胶状沉淀生成 | H2CO3酸性大于H2SiO3 | 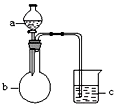 |
| B | 浓盐酸 | MnO2 | 石蕊 试液 | 石蕊试液先 变红后褪色 | 氯气具有漂白性 | |
| C | 稀硫酸 | 锌粒 | 水 | 一段时间有气泡 | 反应生成了H2 | |
| D | NaOH溶液 | Al | 水 | 产生大量气泡 | Al能与NaOH 溶液反应 |
| A. | A | B. | B | C. | C | D. | D |
16.下列变化过程,属于放热反应的是( )
| A. | NaOH溶于水 | B. | 蜡烛燃烧 | C. | 干冰气化 | D. | 碘升华 |
6.下列各组物质中,前者为电解质,后者为非电解质的是( )
| A. | 硫酸,硫酸钡 | B. | NH3,氢氧化钠 | C. | 盐酸,醋酸 | D. | 食盐,酒精 |
13.在压强为2.20×104KPa、温度达到374℃时,水成为“超临界状态”,此时水可与CO2等含碳化合物反应生成有机物,这就是“水热反应”,生物质在地下高温高压条件下通过水热反应可生成石油、煤等矿物能源.下列说法不正确的是( )
| A. | “水热反应”是一种复杂的化学变化 | |
| B. | 二氧化碳与超临界水作用生成汽油的反应,属于放热反应 | |
| C. | 火力发电厂可望利用废热,将二氧化碳转变为能源物质 | |
| D. | 随着科技的进步,“水热反应”制取能源有望实现地球上碳资源的和谐循环 |
10.在一定温度下的密闭容器中,当下列物理量不再变化时,表明A(s)+2B(g)?C(g)+D(g)已达平衡的是( )
| A. | 混合气体的压强 | B. | C和D物质的量浓度相等 | ||
| C. | 混合气体的密度 | D. | 混合气体的总物质的量 |
10.下列说法正确的是( )
| A. | 常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0 | |
| B. | 已知2CO(g)+O2(g)=2CO2(g)△H=-566 kJ•mol-1,则CO的燃烧热△H=-283 kJ | |
| C. | 已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1,则稀H2SO4溶液和稀Ba(OH)2溶液反应的反应热△H═2×(-57.3)kJ•mol-1 | |
| D. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,热化学方程式为:N2(g)+3H2(g)$?_{500℃/30Mpa}^{催化剂}$ 2NH3(g)△H=-38.6 kJ•mol-1 |