题目内容
8.某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:(1)A装置的作用是制得水蒸气,B中反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(2)D的作用是干燥氢氢(或除掉氢气中的水蒸气).
(3)E中的现象是硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成.
(4)A、B两个装置中应先点燃A处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是收集H2,并检验其纯度.
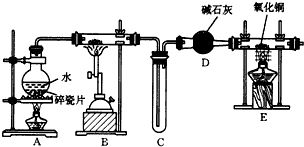
分析 (1)根据铁与水蒸气反应的条件是高温,水的状态是气体分析可知A装置的作用是造水蒸气,B中是铁与水蒸气反应生成氢气和四氧化三铁;
(2)E是氢气还原氧化铜的实验,气体进入E装置前要干燥,否则会有危险,硬质玻璃管可能炸裂;
(3)根据氢气还原氧化铜得到铜和水进行分析;
(4)若先点燃B处,铁会与氧气先发生反应,所以须先点燃A处; 氢气是可燃性气体混有空气会发生爆炸,需要验纯.
解答 解:(1)铁与水蒸气反应的条件是高温,水的状态是气体,所以A装置的作用是造水蒸气,B中是铁与水蒸气反应生成氢气和四氧化三铁,方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:制得水蒸气; 3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(2)E是氢气还原氧化铜的实验,气体进入E装置前要干燥,否则会有危险,硬质玻璃管可能炸裂,
故答案为:干燥氢氢(或除掉氢气中的水蒸气);
(3)氢气还原氧化铜得到铜和水即H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,所以硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成,
故答案为:硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成;
(4)若先点燃B处,铁会与氧气先发生反应,所以须先点燃A处;氢气是可燃性气体混有空气会发生爆炸,所以点燃E处酒精灯之前应进行的操作是验证氢气的纯度,方法是:收集一试管气体,将试管口靠近酒精灯火焰,弱发出噗的声音,说明气体纯净;若发生尖锐爆鸣声,说明气体不纯,
故答案为:A;收集H2,并检验其纯度.
点评 本题考查了铁与水蒸气反应方程式的书写,利用氢气还原氧化铜这个实验对产物氢气进行检验,考查了实验操作中的注意事项,题目较简单.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案| A. | 一定量的Na与O2完全反应生成1mol产物时,转移电子数为2NA | |
| B. | 23g乙醇与足量金属钠完全反应时,可生成5.6L氢气 | |
| C. | 1molHCl气体与1molNH3完全反应时,可生成NA个NH4Cl分子 | |
| D. | 若1molCH4与1molCl2光照下充分反应,则生成的一氯甲烷分子的数目为NA |
| 阳离子 | Cu2+、Fe3+、Al3+、K+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42- |
I.取少量废水样品,加入KSCN溶液无明显变化.
Ⅱ.另取少量废水样品,逐滴加入NaOH溶液,产生沉淀,继续滴加过量的NaOH溶液,沉淀部分溶解.
请回答下列问题:
(1)废水中一定含有的金属阳离子是Al3+Cu2+(填离子符号).
(2)Ⅱ中沉淀部分溶解过程中发生反应的离子方程式是Al(OH)3+OH-=[Al(OH)4]-.
(3)甲同学通过分析最终确定废水中一定不能大量存在上表所列四种阴离子中的CO32-(填离子符号),其判断理由是Al3+与CO32-在水溶液中同时发生水解且两个水解过程相互促进,故废水中不能大量存在CO32-(或Cu2+与CO32-结合生成CuCO3沉淀,故废水中不能大量存在CO32-).
 )是生活中常用食品添加剂-味精.在100℃以上使用味精,谷氨酸钠会转变为对人体有害的物质.下列有关味精的说法中正确的是( )
)是生活中常用食品添加剂-味精.在100℃以上使用味精,谷氨酸钠会转变为对人体有害的物质.下列有关味精的说法中正确的是( )| A. | 化学式为C5H9NO4Na | |
| B. | 味精难溶于水 | |
| C. | 只能和盐酸反应,不能和氢氧化钠溶液反应 | |
| D. | 炒菜时味精不宜早放 |
| A. | 正极附近的 SO42-离子浓度逐渐增大 | |
| B. | 电子通过导线由铜片流向锌片 | |
| C. | 溶液的pH逐渐变小 | |
| D. | 铜片上有H2逸出 |
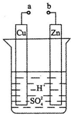 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
