题目内容
7.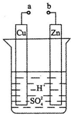 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:(1)a和b用导线连接时,Cu极为原电池正极(填“正”或“负”),电极反应式为2H++2e-=H2,Zn极发生正;2H++2e-=H2↑;氧化;Cu(填“氧化”或“还原”)反应,溶液中H+移向Cu(填“Cu”或“Zn”)极.
(2)无论a和b是否连接,Zn片均被腐蚀.若转移了0.2mol电子,则理论上Zn片质量减轻6.5g.
(3)有同学向把Ba(OH)2•8H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行?否(填“是”或“否”),理由是此反应为非氧化还原反应,且反应吸热;.
(4)研究表明,在一定条件下2mol H2O(g)和1mol O2(g)完全化合生成2molH2O(g)放出的热量:①与在相同条件下2mol H2O(g)完全分解为2mol H2(g)和1mol O2(g)所吸收的热量数值上相等;②在一定温度和压强下,1mol H2(g)和0.5mol O2(g)完全化合生成1mol H2O(g)放出的2倍;③比在相同条件下2mol H2(g)和1mol O2(g)完全化合生成2mol H2O(I)放出的热量少.由此,你得到结论是同一个反应正向放出的热量与逆向吸收的热量数值相等,焓变与化学计量数成正比,液态水转变为气态水要吸收热量.
分析 (1)该装置构成原电池,锌易失电子作负极、Cu作正极,负极电极反应为Zn-2e-=Zn2+、正极反应为2H++2e-=H2↑,放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动;
(2)根据锌和转移电子之间的关系式计算;
(3)原电池反应必须是自发进行的放热的氧化还原反应;
(4)焓变与化学计量数成正比,正向为放热,逆向为吸热,同一个反应正向放出的热量与逆向吸收的热量数值相等,液态水转变为气态水要吸收热量.
解答 解:(1)该装置为原电池,锌易失电子作负极、Cu作正极,正极上氢离子放电,电极反应为2H++2e-=H2↑,锌失电子发生氧化反应,电解质溶液中氢离子向正极Cu极移动,故答案为:正;2H++2e-=H2↑;氧化;Cu;
(2)根据锌和转移电子之间的关系式得,消耗锌的质量=$\frac{0.2mol}{2}$=0.1mol,其质量为6.5g,故答案为:6.5;
(3)原电池反应必须是自发进行的放热的氧化还原反应,该反应是吸热反应且不是氧化还原反应,所以不能设计成原电池,故答案为:否;此反应为非氧化还原反应,且反应吸热;
(4)焓变与化学计量数成正比,正向为放热,逆向为吸热,同一个反应正向放出的热量与逆向吸收的热量数值相等,液态水转变为气态水要吸收热量,故答案为:同一个反应正向放出的热量与逆向吸收的热量数值相等,焓变与化学计量数成正比,液态水转变为气态水要吸收热量.
点评 本题考查了原电池原理及原电池设计,根据原电池反应特点、电极反应等知识点分析解答,铜锌原电池中电池反应式与锌发生化学腐蚀离子反应相同,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.硫酸工业是利用反应2SO2+O2?2SO3制备SO3,该反应为放热反应.温度和压强对SO2平衡转化率影响的数据如下表.
从成本角度考虑,应选用的适宜压强和温度条件是( )
| 压强/MPa | ||||
| SO2平衡 | ||||
| 转化率/% | ||||
| 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
| A. | 0.1 MPa,400℃ | B. | 0.5 MPa,500℃ | C. | 1 MPa,600℃ | D. | 10 MPa,600℃ |
18.下列说法正确的是( )
| A. | 3≤原子最外层电子数<8的元素一定是非金属元素 | |
| B. | 原子最外层只有2个电子的元素一定是第ⅡA族元素 | |
| C. | 最外层电子数比次外层电子数多的元素一定是第二周期元素 | |
| D. | 某元素的离子最外层电子数与次外层电子数相同,该元素一定位于第三周期 |
2.下列反应中,属于加成反应的是( )
| A. | 苯与液溴在FeBr3催化下生成溴苯 | |
| B. | 乙醇在铜做催化剂的条件下,被空气中的氧气氧化成乙醛 | |
| C. | 乙烯使溴水褪色 | |
| D. | 乙酸与乙醇反应生成乙酸乙酯 |
12.“魔酸”酸性是浓硫酸的1亿倍,可以将正丁烷转化为异丁烷,下列关于这一转化的说法中错误的是( )
| A. | 是化学变化 | B. | 没有能量变化 | ||
| C. | 有C-C、C-H键的断裂 | D. | 有C-C、C-H键的形成 |
16.一定条件下,碳钢腐蚀与溶液pH的关系如下表,下列说法不正确的是( )
| pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
| 腐蚀快慢 | 较快 | 慢 | 较快 | ||||
| 主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2- |
| A. | 在pH<4的溶液中,碳钢主要发生析氢腐蚀 | |
| B. | 在pH>6的溶液中,碳钢主要发生吸氧腐蚀 | |
| C. | 在pH>14的溶液中,碳钢腐蚀的正极反应为O2+4OH-+4e-═2H2O | |
| D. | 在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减慢 |
 +2H2O;
+2H2O;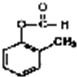 发生银镜反应的化学方程式:
发生银镜反应的化学方程式: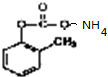 +2Ag↓+3NH3+H2O;
+2Ag↓+3NH3+H2O; 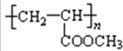 .
.