题目内容
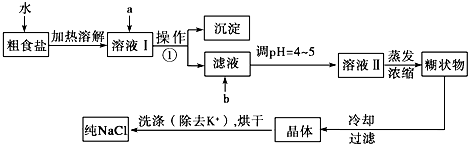
13.为了检测熟肉中NaNO2含量,某兴趣小组从1000g隔夜熟肉中提取NaNO3和NaNO2后配成溶液,用0.00500mol•L-1的高锰酸钾(酸性)溶液滴定.平行测定三次,求出每次NaNO2含量,取其平均值.(已知:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O)
(1)滴定前排气泡时,应选择图中的②(填序号).
(2)滴定终点的判断依据为当滴入最后一滴高锰酸钾溶液时,溶液的颜色变浅紫红色,且半分钟内不褪色
(3)下列操作会导致样品含量测定值偏高的是BD(填字母).
A.锥形瓶用蒸馏水洗后未用待测液润洗
B.酸式滴定管用蒸馏水洗后未用标准液润洗
C.滴定过程中振荡锥形瓶时,有少量待测溶液溅出
D.滴定前平视读数,滴定结束仰视读数
(4)某次滴定过程中,消耗高锰酸钾溶液的体积为16.00mL.则此次求得的NaNO2的含量为13.8 mg•kg-1.
分析 (1)根据碱式滴定管的排气泡法进行判断;
(2)高锰酸钾为紫色,当滴定到终点时,NO2-被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色变浅紫红色;
(3)根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(4)根据关系式为2MnO4-~5NO2-,可计算出1000g隔夜熟肉中NaNO2的质量,并据此计算隔夜熟肉中NaNO2的含量.
解答 解:(1)碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,所以排除碱式滴定管中的空气用②的方法;
故答案为:②;
(2)高锰酸钾为紫色,当滴定到终点时,NO2-被完全氧化,加入的最后一滴高锰酸钾不反应,溶液的颜色变浅紫红色,且半分钟内不褪色,说明达到滴定终点;
故答案为:当滴入最后一滴高锰酸钾溶液时,溶液的颜色变浅紫红色,且半分钟内不褪色;
(3)A.锥形瓶用蒸馏水洗后未用待测液润洗,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,c(标准)不变,故A错误;
B.酸式滴定管用蒸馏水洗后未用标准液润洗,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,c(标准)偏大,故B正确;
C.滴定过程中振荡锥形瓶时,有少量待测溶液溅出,造成V(标准)偏小,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,c(标准)偏小,故C错误;
D.滴定前平视读数,滴定结束仰视读数,造成V(标准)偏大,根据c(待测)=$\frac{c(标注)×V(标准)}{V(待测)}$分析,c(标准)偏大,故D正确;
故选BD.
(4)由关系式为2MnO4-~5NO2-,可计算出1000g隔夜熟肉中NaNO2的质量为2.5×0.00500mol/L×16.00mL×10-3$\frac{L}{mL}$×69g/mol=13.8mg,所以隔夜熟肉中NaNO2的含量为13.8mg/kg,
故答案为:13.8.
点评 本题主要考查物质含量的测定,中等难度,答题时注意把元素化合物知识与实验原理充分结合.

| A. | 是化学变化 | B. | 没有能量变化 | ||
| C. | 有C-C、C-H键的断裂 | D. | 有C-C、C-H键的形成 |
| AgCl | Ag2CrO4 | Ag2S | AgBr | AgI | |
| 颜色 | 白色 | 橘红色 | 黑色 | 淡黄色 | 黄色 |
| Ksp | 1.8×10-10 | 1.1×10-12 | 6.0×10-50 | 7.7×10-13 | 8.5×10-16 |
| A. | 往Ag2S悬浊液中加入少量K2CrO4溶液,沉淀将由黑色变成橘红色 | |
| B. | 反应2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq)的平衡常数K=5.4×1029 | |
| C. | 用AgNO3标准溶液测定溶液中的c(Cl-),可用K2CrO4或K2S溶液作指示剂 | |
| D. | 在20mL浓度均为1.8×10-6mol•L-1的Cl-、Br-及I-的混合溶液中,逐滴(1滴约0.05mL)加入0.01mol•L-1的AgNO3溶液,可依次得到AgCl、AgBr和AgI沉淀 |
| A. | 金刚石网状结构中,由共价键形成的碳原子环其中最小环有6个碳原子 | |
| B. | 在氯化钠的晶体中,每个Na+或Cl-的周围都紧邻6个Cl-或Na+ | |
| C. | 在氯化铯晶体中,每个Cs+周围都紧邻8个Cl-,每个Cl-周围也紧邻8个Cs+ | |
| D. | 在干冰的晶体中,每个CO2分子周围都紧邻4个CO2分子 |