题目内容
20.谷氨酸是人体必需的氨基酸,其一钠盐( )是生活中常用食品添加剂-味精.在100℃以上使用味精,谷氨酸钠会转变为对人体有害的物质.下列有关味精的说法中正确的是( )
)是生活中常用食品添加剂-味精.在100℃以上使用味精,谷氨酸钠会转变为对人体有害的物质.下列有关味精的说法中正确的是( )| A. | 化学式为C5H9NO4Na | |
| B. | 味精难溶于水 | |
| C. | 只能和盐酸反应,不能和氢氧化钠溶液反应 | |
| D. | 炒菜时味精不宜早放 |
分析 由结构可知分子式,分子中含-COONa,钠盐均溶于水,含NH3+可与NaOH溶液反应,并结合信息来解答.
解答 解:A.由结构可知分子式为C5H8NO4Na,故A错误;
B.钠盐均溶于水,味精可溶于水,故B错误;
C.含NH3+可与NaOH溶液反应,故C错误;
D.100℃以上使用味精,谷氨酸钠会转变为对人体有害的物质,则炒菜时味精不宜早放,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意钠盐的性质,题目难度不大.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
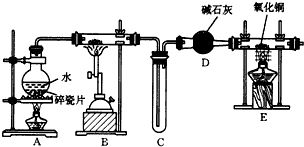
11.某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Fe2+、Al3+ 和Na+.某同学为了确认其成分,取部分试液,设计并完成了如图实验:由此可知原溶液中( )

| A. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| B. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol•L-1 | |
| C. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 | |
| D. | 取少量原溶液于试管中,加入KSCN溶液,溶液成血红色,说明该溶液一定没有Fe2+,只有Fe3+ |
15.能源问题是人类社会面临的重大课题,甲醇是未来重要的绿色能源之一.
(1)利用工业废气CO2可制取甲醇,已知常温常压下下列反应的能量关系如图:

则CO2与H2反应生成CH3OH的热化学方程式为CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol
(2)CH4和H2O(g)通过下列转化也可以制得CH3OH;
I.CH4(g)+H2O(g)?CO(g)+3H2(g)△H1>0
II.CO(g)+2H2(g)?CH3OH(g)△H2<0
将1.0molCH4和3.0molH2O(g)通入反应室(容积为100L)中,在一定条件下发生反应I,CH4的转化率与温度、压强的关系如图所示.

①已知温度为T1℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003 mol•L-1•min-1;
②图中的p1<p2(填“<”、“>”或“=”),判断的理由是该反应正方向为体积增大的方向,相同温度下,压强越大甲烷的转化率减小,P2 的转化率比P1小,说明P2<P1;.
③若反应II在恒容密闭容器进行,下列能判断反应II达到平衡状态的是cd(填序号).
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的总物质的量不变 d.CH3OH、CO、H2的浓度都不再发生变化
④在某温度下,将一定量的CO和H2投入10L的密闭容器中发生反应II,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
若5min时只改变了某一条件,10min时测得各物质浓度如表,则所改变的条件是向容器中充入1molH2;10min时v正>v逆(填“<”、“>”或“=”).
(1)利用工业废气CO2可制取甲醇,已知常温常压下下列反应的能量关系如图:

则CO2与H2反应生成CH3OH的热化学方程式为CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-50KJ/mol
(2)CH4和H2O(g)通过下列转化也可以制得CH3OH;
I.CH4(g)+H2O(g)?CO(g)+3H2(g)△H1>0
II.CO(g)+2H2(g)?CH3OH(g)△H2<0
将1.0molCH4和3.0molH2O(g)通入反应室(容积为100L)中,在一定条件下发生反应I,CH4的转化率与温度、压强的关系如图所示.

①已知温度为T1℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为0.003 mol•L-1•min-1;
②图中的p1<p2(填“<”、“>”或“=”),判断的理由是该反应正方向为体积增大的方向,相同温度下,压强越大甲烷的转化率减小,P2 的转化率比P1小,说明P2<P1;.
③若反应II在恒容密闭容器进行,下列能判断反应II达到平衡状态的是cd(填序号).
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的总物质的量不变 d.CH3OH、CO、H2的浓度都不再发生变化
④在某温度下,将一定量的CO和H2投入10L的密闭容器中发生反应II,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
12.表为部分短周期元素化合价及相应氢化物沸点的数据:
已知:
①A与D可形成化合物AD2、AD3,可用于制备强酸甲;
②B与D可形成化合物BD、BD2,可用于制备强酸乙.
请回答:
(1)表中属于第二周期元素的是H、D、B、F(用元素符号填写).
(2)写出G的最高价氧化物的水化物的化学式:HClO4.
(3)比较A、D、F三种元素简单阴离子的半径大小:rS2->rF->rO2-(均用离子符号表示).
(4)AD2与 BD2混合即发生反应,该反应的化学方程式为:SO2+NO2=SO3+NO.
(5)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是:SOCl2+H2O=SO2↑+2HCl.
(6)工业生产强酸乙时可用纯碱溶液处理尾气,该反应如下:BD+BD2+Na2CO3═2X+CO2,X的化学式应为NaNO2.
| 元素性质 | 元素编号 | |||||||
| A | B | C | D | E | F | G | H | |
| 氢化物的沸点(℃) | -60.7 | -33.4 | -111.5 | 100 | -87.7 | 19.54 | -84.9 | -161.5 |
| 最高化合价 | +6 | +5 | +4 | +5 | +7 | +4 | ||
| 最低化合价 | -2 | -3 | -4 | -2 | -3 | -1 | -1 | -4 |
①A与D可形成化合物AD2、AD3,可用于制备强酸甲;
②B与D可形成化合物BD、BD2,可用于制备强酸乙.
请回答:
(1)表中属于第二周期元素的是H、D、B、F(用元素符号填写).
(2)写出G的最高价氧化物的水化物的化学式:HClO4.
(3)比较A、D、F三种元素简单阴离子的半径大小:rS2->rF->rO2-(均用离子符号表示).
(4)AD2与 BD2混合即发生反应,该反应的化学方程式为:SO2+NO2=SO3+NO.
(5)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸.该反应的化学方程式是:SOCl2+H2O=SO2↑+2HCl.
(6)工业生产强酸乙时可用纯碱溶液处理尾气,该反应如下:BD+BD2+Na2CO3═2X+CO2,X的化学式应为NaNO2.
9.(1)某实验小组设计了下列实验以探究影响化学反应速率的因素.
实验I:在甲、乙、丙三只相同的试管中分别加入5mL质量分数均为5%的过氧化氢溶液,各加入三滴洗涤剂,再分别放到如图所示的烧杯中水浴加热.实验发现,三支试管中产生气泡的速率不同.(洗涤剂起到将气体变为气泡的作用)

实验Ⅱ:在甲、乙、丙三只相同的试管中分别加入5mL质量分数均为5%的过氧化氢溶液,各加入三滴洗涤剂.在甲试管中加入MnO2少许,在乙试管中加入少许FeCl3,在丙中加入少许新鲜的鸡肝泥.观察到乙试管中产生气泡的速率最慢,而丙试管中产生气泡的速率最快.
实验Ⅲ:在甲、乙、丙三只相同的试管中分别加入5mL质量分数分别为5%,10%和15%的过氧化氢溶液,各加入三滴洗涤剂,再分别滴加三滴浓FeCl3溶液.观察并记录实验现象.
实验Ⅳ:在甲、乙、丙三只相同的试管中分别加入少许鸡肝泥,再分别放到如图所示的烧杯中水浴加热2分钟,再分别向三支试管中加入5mL质量分数均为5%的过氧化氢溶液和三滴洗涤剂.观察到丙中产生气泡速率最慢.

根据上述四个实验,回答下列问题:
①实验I的实验现象是丙中产生气泡速率最快,甲中最慢.
②实验Ⅱ的实验目的是探究MnO2、FeCl3和鸡肝泥三种催化剂对反应速率的影响大小.
③实验Ⅲ的实验目的是探究浓度对反应速率的影响;产生气泡速率最快的是丙试管(填“甲”“乙”或“丙”).
④实验Ⅳ中丙产生气泡速率最慢,该实验现象的原因可能是在80℃时,鸡肝泥失去或降低了催化效率.
(2)在一定温度下,将0.20 mol 的四氧化二氮气体充入1L的固定的密闭容器,每隔一段时间对该容器内的物质进行一次分析,得到如下数据:
根据表格提供数据,请回答下列各小题:
①C1<C2(填<,>或=).
②在0~20S内四氧化二氮的平均反应速度为0.003mol/(L•s).1.
实验I:在甲、乙、丙三只相同的试管中分别加入5mL质量分数均为5%的过氧化氢溶液,各加入三滴洗涤剂,再分别放到如图所示的烧杯中水浴加热.实验发现,三支试管中产生气泡的速率不同.(洗涤剂起到将气体变为气泡的作用)

实验Ⅱ:在甲、乙、丙三只相同的试管中分别加入5mL质量分数均为5%的过氧化氢溶液,各加入三滴洗涤剂.在甲试管中加入MnO2少许,在乙试管中加入少许FeCl3,在丙中加入少许新鲜的鸡肝泥.观察到乙试管中产生气泡的速率最慢,而丙试管中产生气泡的速率最快.
实验Ⅲ:在甲、乙、丙三只相同的试管中分别加入5mL质量分数分别为5%,10%和15%的过氧化氢溶液,各加入三滴洗涤剂,再分别滴加三滴浓FeCl3溶液.观察并记录实验现象.
实验Ⅳ:在甲、乙、丙三只相同的试管中分别加入少许鸡肝泥,再分别放到如图所示的烧杯中水浴加热2分钟,再分别向三支试管中加入5mL质量分数均为5%的过氧化氢溶液和三滴洗涤剂.观察到丙中产生气泡速率最慢.

根据上述四个实验,回答下列问题:
①实验I的实验现象是丙中产生气泡速率最快,甲中最慢.
②实验Ⅱ的实验目的是探究MnO2、FeCl3和鸡肝泥三种催化剂对反应速率的影响大小.
③实验Ⅲ的实验目的是探究浓度对反应速率的影响;产生气泡速率最快的是丙试管(填“甲”“乙”或“丙”).
④实验Ⅳ中丙产生气泡速率最慢,该实验现象的原因可能是在80℃时,鸡肝泥失去或降低了催化效率.
(2)在一定温度下,将0.20 mol 的四氧化二氮气体充入1L的固定的密闭容器,每隔一段时间对该容器内的物质进行一次分析,得到如下数据:
| 时间 (s) 浓度 mol•L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | C1 | 0.10 | C3 | C4 | C5 |
| C(NO2) | 0.00 | 0.12 | C2 | 0.22 | 0.22 | 0.22 |
①C1<C2(填<,>或=).
②在0~20S内四氧化二氮的平均反应速度为0.003mol/(L•s).1.
10.为了鉴定氯乙烷中氯元素的存在,以下各步实验:①加入AgNO3溶液②加入NaOH的醇溶液,③加热 ④用HNO3酸化溶液 ⑤加入NaOH的水溶液其中操作顺序合理的是( )
| A. | ①②③⑤ | B. | ②③④① | C. | ④③⑤① | D. | ⑤③④① |