题目内容
用盐酸滴定未知浓度的氢氧化钠溶液,下列操作导致结果偏低的是( )
| A、酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B、滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C、酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D、读取盐酸体积时,开始仰视读数,滴定结束时平视读数 |
考点:中和滴定
专题:化学实验基本操作
分析:根据c(待测)=
来分析不当操作对V(标准)的影响,以此判断浓度的误差.
| V(标准)×c(标准) |
| V(待测) |
解答:
解:A、酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,盐酸被稀释,浓度减小,造成V(标准)偏大,根据c(待测)=
可知,c(待测)偏大,故A错误;
B、滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=
可知,c(待测)不变,故B错误;
C、酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=
可知,c(待测)偏大,故C错误;
D、读取盐酸体积时,开始仰视读数,滴定结束时平视读数,造成V(标准)偏小,根据c(待测)=
可知,c(待测)偏小,故D正确;
故选D.
| V(标准)×c(标准) |
| V(待测) |
B、滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=
| V(标准)×c(标准) |
| V(待测) |
C、酸式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=
| V(标准)×c(标准) |
| V(待测) |
D、读取盐酸体积时,开始仰视读数,滴定结束时平视读数,造成V(标准)偏小,根据c(待测)=
| V(标准)×c(标准) |
| V(待测) |
故选D.
点评:分析误差时要看是否影响标准体积的用量,若标准体积偏大,结果偏高;若标准体积偏小,则结果偏小;若不影响标准体积,则结果无影响.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
下列溶液中,各组离子一定能大量共存的是( )
| A、使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+ |
| B、使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- |
| C、碳酸氢钠溶液:K+、SO42-、Cl-、H+ |
| D、c(H+)=10-12 mol?L-1的溶液:K+、Ba2+、Cl-、Br- |
 实验室里有一瓶试剂的标签部分被腐蚀,如图所示,仅知该试剂是只含短周期元素的纯净物.某同学设计实验探究该试剂成分,实验现象和结论都正确的是( )
实验室里有一瓶试剂的标签部分被腐蚀,如图所示,仅知该试剂是只含短周期元素的纯净物.某同学设计实验探究该试剂成分,实验现象和结论都正确的是( )| A、取该样品加入足量的硝酸钡溶液和稀盐酸,产生白色沉淀,则该样品的成分一定是硫酸钠 |
| B、取该样品溶于水,测得溶液pH=10,将溶液放置在空气中,一段时间后再测定溶液pH=7,该样品可能是亚硫酸钠 |
| C、取该样品溶于水,加入足量稀硫酸,将产生气体通入品红溶液,品红溶液褪色,加热溶液变红色,则样品成分是Na2S |
| D、若样品成分是硅酸钠(Na2SiO3),溶于水,滴加盐酸至过量,先生成白色沉淀,后沉淀溶解 |
为提纯下列物质(括号内为杂质),选用的试剂和分离方法都正确的是( )
| 物质 | 试剂 | 分离方法 | |
| ① | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| ② | 溴乙烷(乙醇) | HBr | 分液 |
| ③ | 乙醇(水) | 生石灰 | 蒸馏 |
| ④ | 苯(苯酚) | 浓溴水 | 过滤 |
| A、①② | B、①③ | C、只有③ | D、③④ |
以下对元素的性质判断正确的是( )
| A、元素的最高价氧化物的水化物碱性越强,该元素的金属性就越强 |
| B、元素的气态氢化物的水溶液酸性越强,该元素的非金属性就越强 |
| C、元素的单质和水的反应越剧烈,该元素的非金属性就越强 |
| D、元素的单质越容易和氢气化合,该元素的金属性就越强 |
 ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题: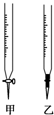 温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步: 某学生用物质的量的浓度为a mol/L的标准NaOH去测定V mL HCl溶液的物质的量浓度.用甲基橙作指示剂. 回答下列问题:
某学生用物质的量的浓度为a mol/L的标准NaOH去测定V mL HCl溶液的物质的量浓度.用甲基橙作指示剂. 回答下列问题: