题目内容
 ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:(1)S单质的常见形式为S8,其环状结构如图2所示,S原子采用的轨道杂化方式是
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为
(3)H2Se的酸性比H2S
(4)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释;
①H2SeO4和H2SeO3第一步电离程度大于第二部电离的原因:
②H2SeO4和H2SeO3酸性强的原因:
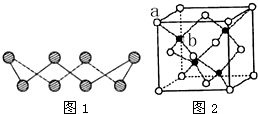
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛.立方ZnS晶体结构如图1所示,其晶胞边长为540.0pm,a位置S2-离子与b位置Zn2+离子之间的距离为
考点:晶胞的计算,同一主族内元素性质递变规律与原子结构的关系,元素电离能、电负性的含义及应用,原子轨道杂化方式及杂化类型判断,弱电解质在水溶液中的电离平衡
专题:
分析:(1)由S8分子结构可知,在S8分子中S原子成键电子对数为2,孤电子对数为2,即价层电子对数为4;
(2)同主族元素从上到下元素的第一电离能逐渐减小;
(3)根据中心原子形成的价层电子对判断杂化类型和分子的立体构型;
(4))①酸第一步电离产生的酸根阴离子带有负电荷,由于异种电荷相互吸引,第一步产生的H+抑制第二步电离11;
②H2SeO3的分子结构为 ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为 ,Se为+6价,后者Se原子吸电子能力强;
,Se为+6价,后者Se原子吸电子能力强;
(5)第一问我们常碰到,后面一问要注意四个Zn2+在体内的四个小立方体的中心,不在同一平面上,过b向上面作垂线,构成直角三角形,两边分别为
;
a,即可求出斜边为
a(a 为晶胞边长).
(2)同主族元素从上到下元素的第一电离能逐渐减小;
(3)根据中心原子形成的价层电子对判断杂化类型和分子的立体构型;
(4))①酸第一步电离产生的酸根阴离子带有负电荷,由于异种电荷相互吸引,第一步产生的H+抑制第二步电离11;
②H2SeO3的分子结构为
 ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为 ,Se为+6价,后者Se原子吸电子能力强;
,Se为+6价,后者Se原子吸电子能力强;(5)第一问我们常碰到,后面一问要注意四个Zn2+在体内的四个小立方体的中心,不在同一平面上,过b向上面作垂线,构成直角三角形,两边分别为
| ||
| 4 |
| 1 |
| 4 |
| ||
| 4 |
解答:
解:(1)由S8分子结构可知,在S8分子中S原子成键电子对数为2,孤电子对数为2,即价层电子对数为4,因此S原子采用的杂化轨道方式为sp3,故答案为:sp3;
(2)同主族元素从上到下元素的第一电离能逐渐减小,则有O>S>Se,故答案为:O>S>Se;
(3)同主族元素对应的氢化物中,元素的非金属性越强,对应的氢化物的酸性越弱,则H2Se的酸性比H2S强,
气态SeO3分子中Se形成3个δ键,没有孤电子对,为平面三角形分子,SO32-中S形成3个δ键,孤电子对数为
=1,则为三角锥形,
故答案为:强;平面三角形;三角锥形;
(4)①酸第一步电离产生的酸根阴离子带有负电荷,吸引H+,同时产生的H+抑制第二步电离,所以H2SeO4和H2SeO3第一步电离程度大于第二部电离程度,导致第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子,
故答案为:第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子;
②H2SeO3的分子结构为 ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为 ,Se为+6价,后者Se原子吸电子能力强,导致Se-O-H中的O原子更向Se偏移,则羟基上氢原子更容易电离出H+,
,Se为+6价,后者Se原子吸电子能力强,导致Se-O-H中的O原子更向Se偏移,则羟基上氢原子更容易电离出H+,
故答案为:H2SeO3和H2SeO4可表示为 (HO)SeO2和 (HO)2SeO2.H2SeO3中Se为+4价,而H2SeO4中Se为+6价,正电性更高.导致Se-O-H中的O原子更向Se偏移,越易电离出H+;
(5)晶胞中含有S离子位于顶点和面心,共含有8×
+6×
=4,Zn离子位于体心,共4个,则晶胞中平均含有4个ZnS,四个Zn2+在体内的四个小立方体的中心,不在同一平面上,过b向上面作垂线,构成直角三角形,两边分别为
;
a,即可求出斜边为
a(a 为晶胞边长),则a位置S2-离子与b位置Zn2+离子之间的距离为
×540.0pm=135
pm或
或
,
故答案为:135
pm或
或
.
(2)同主族元素从上到下元素的第一电离能逐渐减小,则有O>S>Se,故答案为:O>S>Se;
(3)同主族元素对应的氢化物中,元素的非金属性越强,对应的氢化物的酸性越弱,则H2Se的酸性比H2S强,
气态SeO3分子中Se形成3个δ键,没有孤电子对,为平面三角形分子,SO32-中S形成3个δ键,孤电子对数为
| 6+2-2×3 |
| 2 |
故答案为:强;平面三角形;三角锥形;
(4)①酸第一步电离产生的酸根阴离子带有负电荷,吸引H+,同时产生的H+抑制第二步电离,所以H2SeO4和H2SeO3第一步电离程度大于第二部电离程度,导致第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子,
故答案为:第一步电离后生成的负离子较难再进一步电离出带正电荷的氢离子;
②H2SeO3的分子结构为
 ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为 ,Se为+6价,后者Se原子吸电子能力强,导致Se-O-H中的O原子更向Se偏移,则羟基上氢原子更容易电离出H+,
,Se为+6价,后者Se原子吸电子能力强,导致Se-O-H中的O原子更向Se偏移,则羟基上氢原子更容易电离出H+,故答案为:H2SeO3和H2SeO4可表示为 (HO)SeO2和 (HO)2SeO2.H2SeO3中Se为+4价,而H2SeO4中Se为+6价,正电性更高.导致Se-O-H中的O原子更向Se偏移,越易电离出H+;
(5)晶胞中含有S离子位于顶点和面心,共含有8×
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| 4 |
| 1 |
| 4 |
| ||
| 4 |
| ||
| 4 |
| 3 |
| 270 | ||
|
135
| ||
sin
|
故答案为:135
| 3 |
| 270 | ||
|
135
| ||
sin
|
点评:本题综合考查物质结构与性质相关知识,涉及杂化轨道、第一电离能、电负性、电子排布式、分子的立体构型、晶胞的计算等,难度较大,需要学生具有扎实的基础与灵活运用的能力.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
石英光导纤维的主要成分是( )
| A、Si |
| B、SiC |
| C、SiO2 |
| D、Na2SiO3 |
检验某溶液中是否含有SO42-时,为防止Ag+、CO32-、SO32-等离子的干扰,下列实验方案比较严密的是( )
| A、先加稀HCl将溶液酸化,再滴加BaCl2溶液,看是否生成白色沉淀 |
| B、先加稀HNO3将溶液酸化,再滴加BaCl2溶液,看是否生成白色沉淀 |
| C、向溶液中滴加稀盐酸酸化的BaCl2溶液,看是否生成白色沉淀 |
| D、向溶液中滴加稀硝酸酸化的BaCl2溶液,看是否生成白色沉淀 |
在某恒定温度下,向容积为1L的容器中投入1mol CO和2mol H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g),平衡时生成CO2
mol.若保持温度和容积不变,向其中增加2mol H2O(g),使反应到达新的平衡,下列说法不正确的是( )
| 2 |
| 3 |
| A、新、旧平衡时容器内气体的压强之比是5:3 |
| B、新平衡时H2O的转化率为20% |
| C、新平衡时CO的浓度是0.2 mol?L-1 |
| D、新、旧平衡时容器内气体密度之比为5:3 |
用盐酸滴定未知浓度的氢氧化钠溶液,下列操作导致结果偏低的是( )
| A、酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B、滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C、酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D、读取盐酸体积时,开始仰视读数,滴定结束时平视读数 |
食品卫生与身体健康密切相关,下列做法中对人体健康不会造成危害的是( )
| A、食品中添加苏丹红 |
| B、用小苏打做发酵粉 |
| C、福尔马林(35%-40%甲醛水溶液)浸泡海产品 |
| D、用硫磺薰制白木耳用 |
下列说法正确的是( )
| A、用惰性电极电解稀硫酸溶液,实质上是电解水,故溶液p H不变 |
| B、浓度相同的NaX与NaY溶液的PH分别为8和9,由此可知HX的酸性比HY的弱 |
| C、pH相同的CH3COOH和NH4Cl溶液中,水的电离程度相同 |
| D、常温下将0.1mol/L的醋酸溶液稀释时,平衡向电离方向移动,但平衡常数值不变 |