题目内容
4.某同学进行了硫代硫酸钠与硫酸反应的有关实验,实验过程的数据记录如表(见表格),请结合表中信息,回答有关问题:( Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O)| 实验 序号 | 反应温 度/℃ | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
(2)在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件,其中:
①能说明温度对该反应速率影响的组合是BD(填实验序号,下同);
②A和B、A和C的组合比较,所研究的问题是相同温度条件下浓度对该反应速率的影响;
③B和C的组合比较,所研究的问题是相同温度条件下,该反应速率更大程度上取决于哪种反应物的浓度
(3)教材中利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小进行比较:SO2可溶于水,测定不精确或实验装置较复杂,不易控制.
分析 (1)温度越高,反应速率越快,浓度越大反应速率越快;
(2)①当分析某一因素对化学反应速率的影响时,其它物理量要相同;
②A和B、A和C的组合中不同的物理量是浓度,所以比较所研究的问题是相同温度条件下浓度对该反应速率的影响;
③B和C的组合不同点是:硫代硫酸钠和硫酸的浓度不同,所以比较所研究的问题是相同温度条件下,比较速率的不同;
(3)根据二氧化硫的溶解性强,1体积水能溶解40体积二氧化硫.
解答 解:(1)温度越高,反应速率越快,浓度越大反应速率越快,在上述实验中反应速率最快的可能是D,故选D;
(2)①能说明温度对该反应速率影响的组合中两者的温度不同,其它物理量相同,故选BD;
②A和B、A和C的组合中不同的物理量是浓度,所以比较所研究的问题是相同温度条件下浓度对该反应速率的影响,
故答案为:相同温度条件下浓度对该反应速率的影响;
③B和C的组合不同点是:硫代硫酸钠和硫酸的浓度不同,所以比较所研究的问题是相同温度条件下,该反应速率更大程度上取决于哪种反应物的浓度,
故答案为:相同温度条件下,该反应速率更大程度上取决于哪种反应物的浓度;
(3)二氧化硫可以溶于水,1体积水能溶解40体积二氧化硫,所以导致测定不精确,且该实验装置较复杂,不易控制,所以不采用排水法测量单位时间内气体体积的大小进行比较,故答案为:SO2可溶于水,测定不精确或实验装置较复杂,不易控制.
点评 本题考查探究影响化学反应速率的因素,做对比实验时,只有改变一个条件,其它物理量相同才能得出正确结论,难度不大.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
5.NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 44gCO2和N2O的混合物中含有的氧原子数为1.5NA | |
| B. | 2L0.5mol•L-1亚硫酸氢钠溶液中含有的HSO3-离子数为NA | |
| C. | 0.5molCH5+中含有的电子数目为5NA | |
| D. | 常温下,1L0.5mol•L-1Ba(OH)2溶液中水电离的OH-个数为0.1NA |
15.3.87克锌铜合金完全溶解于150mL、密度为1.20g/cm3、质量分数为21%的稀硝酸中,得到NO气体896mL (标准状况),向反应后的溶液中加入适量的1.0mol/LNaOH溶液,恰使溶液中的金属离子全部沉淀.下列说法不正确是( )
| A. | 该稀硝酸中HNO3的物质的量浓度是4.0mol/L | |
| B. | 加入NaOH溶液的体积是560mL | |
| C. | 被还原的硝酸的物质的量为0.04mol | |
| D. | 得到的金属氢氧化物的沉淀为5.81克 |
12.有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阳离子和一种阴离子,且互不重复).
己知:①A、C溶液的pH均大于7,B溶液的pH小于7,A、B溶液中水的电离程度相同,D溶液的焰色反应(透过蓝色钴玻璃)显紫色.
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成有刺激性气味的气体,A溶液和D溶液混合时无明显现象.
(1)A的化学式为CH3COONa.
(2)用离子方程式表不B溶液的pH小于7的原因:NH4++H2O?NH3•H2O+H+.
(3)写出C溶液和D溶液反应的离子方程式:Ba2++SO42-=BaSO4↓.
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).
| 阳离子 | K+、Na+、Ba2+、NH4+ |
| 阴离了 | CH3COO-、Cl-、OH-、SO42- |
②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成有刺激性气味的气体,A溶液和D溶液混合时无明显现象.
(1)A的化学式为CH3COONa.
(2)用离子方程式表不B溶液的pH小于7的原因:NH4++H2O?NH3•H2O+H+.
(3)写出C溶液和D溶液反应的离子方程式:Ba2++SO42-=BaSO4↓.
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).
13.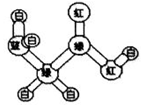 某期刊封面上有如下一个分子的球棍模型图:图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.该模型图可代表一种( )
某期刊封面上有如下一个分子的球棍模型图:图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.该模型图可代表一种( )
 某期刊封面上有如下一个分子的球棍模型图:图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.该模型图可代表一种( )
某期刊封面上有如下一个分子的球棍模型图:图中“棍”代表单键或双键或三键,不同颜色的球代表不同元素的原子.该模型图可代表一种( )| A. | 卤代羧酸 | B. | 酯 | C. | 氨基酸 | D. | 醛 |
14.环丙烷叉环丙烷结构为: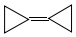 ,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )
,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )
 ,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )
,由于其具有特殊的电子结构一直受到理论化学家的关注.下列关于环丙烷叉环丙烷的说法错误的是( )| A. | 一氯取代物有1种 | B. | 是环丙烷的同系物 | ||
| C. | 与环己二烯( 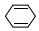 )是同分异构体 )是同分异构体 | D. | 所有的碳原子均在同一平面内 |