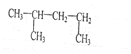
题目内容
5.NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 44gCO2和N2O的混合物中含有的氧原子数为1.5NA | |
| B. | 2L0.5mol•L-1亚硫酸氢钠溶液中含有的HSO3-离子数为NA | |
| C. | 0.5molCH5+中含有的电子数目为5NA | |
| D. | 常温下,1L0.5mol•L-1Ba(OH)2溶液中水电离的OH-个数为0.1NA |
分析 A、CO2和N2O的摩尔质量均为44g/mol,但两者中含有的氧原子个数不同;
B、HSO3-既能电离为亚硫酸根又能水解为亚硫酸;
C、CH5+中含有10个电子;
D、在氢氧化钡溶液中,水的电离被抑制;
解答 解:A、CO2和N2O的摩尔质量均为44g/mol,故44g混合物的物质的量为1mol,但两者中含有的氧原子个数不同,且比例未知,故1mol混合物中含有的氧原子个数无法计算,故A错误;
B、HSO3-既能电离为亚硫酸根又能水解为亚硫酸分子,故此溶液中含有的HSO3-离子数小于NA,故B错误;
C、CH5+中含有10个电子,故0.5molCH5+中含有的电子数目为5NA个,故C正确;
D、在氢氧化钡溶液中,水的电离被抑制,氢氧根几乎全部来自于水的电离,故1L0.5mol/L的氢氧化钡溶液中的0.1NA个氢氧根是氢氧化钡电离出的,水电离出的氢氧根远小于0.1NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
15.下列说法不正确的是( )
| A. | 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口倒出 | |
| B. | 使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干 | |
| C. | 用10 mL量筒量取9.2 mL NaCl溶液 | |
| D. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入稀盐酸和BaCl2溶液 |
16.下列分子的核磁共振氢谱中只有一个峰值的是( )
| A. | CH3CH2CH3 | B. | CH3COOH | C. | CH3COOCH3 | D. | CH3OCH3 |
13.硫酸铵是化工、染织、医药、皮革等工业原料.某硫酸工厂利用副产品Y处理尾气SO2得到CaSO4,再与相邻的合成氨工厂联合制备(NH4)2SO4,工艺流程如图:
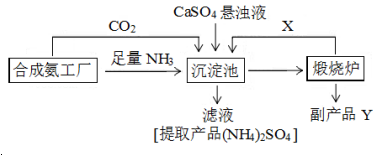
请回答以下问题:
(1)下列有关(NH4)2SO4溶液的说法正确的是
A.电离方程式:(NH4)2SO4?2NH4++SO42-
B.水解离子方程式:NH4++H2O?NH3•H2O+H+
C.离子浓度关系:c(NH4+)+c(H+)═c(SO42-)+c(OH-)
D.微粒浓度大小:c(NH4+)>c(SO42-)>c(H+)>c(NH3•H2O)>c(OH-)
(2)硫酸工业中,V2O5作催化剂时发生反应2SO2+O2?2SO3,SO2的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择表中最合适的温度和压强分别是420℃、1.01×105Pa.该反应420℃时的平衡常数>520℃时的平衡常数(填“>”、“<”或“=”).
(3)在2L密闭容器中模拟接触法制备三氧化硫时,若第12分钟恰好达到平衡,测得生成SO3的物质的量为1.2mol,计算前12分钟用氧气表示反应速率v(O2)为0.025mol/(L.min).
(4)副产品Y是氧化钙.沉淀池中发生的主要反应方程式是CaSO4+CO2+2NH3+H2O→CaCO3↓+(NH4)2SO4.
(5)从绿色化学和资源综合利用的角度说明上述流程的主要优点是产生的CO2循环使用,物质充分利用,副产品有用,无污染性物质产生.

请回答以下问题:
(1)下列有关(NH4)2SO4溶液的说法正确的是
A.电离方程式:(NH4)2SO4?2NH4++SO42-
B.水解离子方程式:NH4++H2O?NH3•H2O+H+
C.离子浓度关系:c(NH4+)+c(H+)═c(SO42-)+c(OH-)
D.微粒浓度大小:c(NH4+)>c(SO42-)>c(H+)>c(NH3•H2O)>c(OH-)
(2)硫酸工业中,V2O5作催化剂时发生反应2SO2+O2?2SO3,SO2的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择表中最合适的温度和压强分别是420℃、1.01×105Pa.该反应420℃时的平衡常数>520℃时的平衡常数(填“>”、“<”或“=”).
 | 1.01×105Pa | 5.05×105Pa | 1.01×106Pa |
| 420℃ | 0.9961 | 0.9972 | 0.9984 |
| 520℃ | 0.9675 | 0.9767 | 0.9852 |
| 620℃ | 0.8520 | 0.8897 | 0.9276 |
(4)副产品Y是氧化钙.沉淀池中发生的主要反应方程式是CaSO4+CO2+2NH3+H2O→CaCO3↓+(NH4)2SO4.
(5)从绿色化学和资源综合利用的角度说明上述流程的主要优点是产生的CO2循环使用,物质充分利用,副产品有用,无污染性物质产生.
10.向含amolBa(OH)2和amolNaOH的混合液中通入bmolCO2,下列说法不正确的是( )
| A. | 当a=b时,发生的离子总反应为:Ba2++2OH-+CO2═BaCO3↓+H2O | |
| B. | 当3a≤2b时发生的离子反应为:OH-+CO2═HCO3- | |
| C. | 当2a=b时,发生的离子总反应为:Ba2++3OH-+2CO2═BaCO3↓+H2O+HCO3- | |
| D. | 2a<b<3a时,溶液中n(HCO3-)=(2b-3a)mol |
6.在一密闭容器中有HCHO、H2和O2混合气体共20g,放入足量Na2O2用电火 花引燃,使其完全反应,Na2O2增重8g,则原混合气体中HCHO、H2和O2的质量比可能是( )
| A. | 1:3:6 | B. | 2:1:6 | C. | 3:5:12 | D. | 1:1:6 |
3.已知碳氢化合物完全燃烧生成CO2和H2O,25°C和101kpa时,C4H8、C2H4和C3H8组成的混合烃20mL与过量氧气混合并完全燃烧,生成二氧化碳和水蒸气.除去水蒸气,恢复到原来的温度和压强,气体的总体积缩小了50mL,原混合烃中C2H4的体积分数为( )
| A. | 75% | B. | 50% | C. | 5% | D. | 12.5% |
4.某同学进行了硫代硫酸钠与硫酸反应的有关实验,实验过程的数据记录如表(见表格),请结合表中信息,回答有关问题:( Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O)
(1)根据你所掌握的知识判断,在上述实验中,反应速率最快的可能是D(填实验序号).
(2)在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件,其中:
①能说明温度对该反应速率影响的组合是BD(填实验序号,下同);
②A和B、A和C的组合比较,所研究的问题是相同温度条件下浓度对该反应速率的影响;
③B和C的组合比较,所研究的问题是相同温度条件下,该反应速率更大程度上取决于哪种反应物的浓度
(3)教材中利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小进行比较:SO2可溶于水,测定不精确或实验装置较复杂,不易控制.
| 实验 序号 | 反应温 度/℃ | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
(2)在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件,其中:
①能说明温度对该反应速率影响的组合是BD(填实验序号,下同);
②A和B、A和C的组合比较,所研究的问题是相同温度条件下浓度对该反应速率的影响;
③B和C的组合比较,所研究的问题是相同温度条件下,该反应速率更大程度上取决于哪种反应物的浓度
(3)教材中利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小进行比较:SO2可溶于水,测定不精确或实验装置较复杂,不易控制.