题目内容
9.A、B、C、D、E、F六种主族元素,其电负性分别为0.9、2.1、1.2、2.5、1.5、3.0.(1)其中属于金属元素的是A、C、E,属于非金属元素的是B、D、F;
(2)按得电子能力由强至若排列的顺序是F>D>B>E>C>A;
(3)化合物A3F、EF2、D2F2中,属于离子化合物的是A3F、EF2,属于共价化合物的是D2F2.
分析 (1)电负性大于1.8的为非金属元素,小于1.8的为金属元素;
(2)电负性越大,元素原子得电子能力越强;
(3)电负性差值大于1.7的一般形成离子键,小于1.7的为共价键.
解答 解:已知A、B、C、D、E、F六种主族元素,其电负性分别为0.9、2.1、1.2、2.5、1.5、3.0;
(1)电负性大于1.8的为非金属元素,小于1.8的为金属元素,则属于金属元素的是A、C、E;属于非金属元素的是B、D、F;
故答案为:A、C、E;B、D、F;
(2)电负性越大,元素原子得电子能力越强,则得电子能力由强至弱排列的顺序是F>D>B>E>C>A;
故答案为:F>D>B>E>C>A;
(3)电负性差值大于1.7的一般形成离子键,则属于离子化合物的是A3F、EF2,小于1.7的为共价键,属于共价化合物的是D2F2;
故答案为:A3F、EF2;D2F2.
点评 本题考查电负性的应用,侧重考查学生对数据的分析处理与归纳总结能力,注意对元素周期律的理解掌握,题目难度不大.

练习册系列答案
相关题目
10.向含amolBa(OH)2和amolNaOH的混合液中通入bmolCO2,下列说法不正确的是( )
| A. | 当a=b时,发生的离子总反应为:Ba2++2OH-+CO2═BaCO3↓+H2O | |
| B. | 当3a≤2b时发生的离子反应为:OH-+CO2═HCO3- | |
| C. | 当2a=b时,发生的离子总反应为:Ba2++3OH-+2CO2═BaCO3↓+H2O+HCO3- | |
| D. | 2a<b<3a时,溶液中n(HCO3-)=(2b-3a)mol |
20.如图用石墨电极电解CuCl2溶液.下列分析正确的是( )
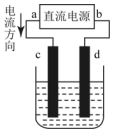

| A. | c极发生还原反应 | B. | 每生成6.4gCu,转移电子0.2mol | ||
| C. | 阳极反应式:Cu2++2e→Cu | D. | 在溶液中电子由d流向c |
17.将等物质的量的X、Y气体充入一个容积可变的密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)?3Z(g)△H<0.当改变某个条件并维持新条件直至达到新平衡,表中关于新平衡与原平衡的比较,正确的是( )
| 选择 | 改变的条件 | 正、逆反应速率变化 | 新平衡和原平衡比较 |
| A | 增大压强 | 正、逆反应速率都增大量 | Z的浓度减小 |
| B | 充入少量Z | 逆反应速率增大 | X的体积分数不变 |
| C | 充入少量Z | v(逆)>v(正) | Z的浓度减小 |
| D | 升高温度 | 逆反应速率增大量大于 正反应速率增大量 | Z的体积分数变大 |
| A. | A | B. | B | C. | C | D. | D |
4.某同学进行了硫代硫酸钠与硫酸反应的有关实验,实验过程的数据记录如表(见表格),请结合表中信息,回答有关问题:( Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O)
(1)根据你所掌握的知识判断,在上述实验中,反应速率最快的可能是D(填实验序号).
(2)在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件,其中:
①能说明温度对该反应速率影响的组合是BD(填实验序号,下同);
②A和B、A和C的组合比较,所研究的问题是相同温度条件下浓度对该反应速率的影响;
③B和C的组合比较,所研究的问题是相同温度条件下,该反应速率更大程度上取决于哪种反应物的浓度
(3)教材中利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小进行比较:SO2可溶于水,测定不精确或实验装置较复杂,不易控制.
| 实验 序号 | 反应温 度/℃ | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
(2)在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件,其中:
①能说明温度对该反应速率影响的组合是BD(填实验序号,下同);
②A和B、A和C的组合比较,所研究的问题是相同温度条件下浓度对该反应速率的影响;
③B和C的组合比较,所研究的问题是相同温度条件下,该反应速率更大程度上取决于哪种反应物的浓度
(3)教材中利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小进行比较:SO2可溶于水,测定不精确或实验装置较复杂,不易控制.
14.下列有关实验操作、现象及结论解释都没有科学性错误的是( )
| 选项 | 操作 | 现象 | 结论解释 |
| A | 过量铁粉与稀HNO3充分反应后滴入KSCN溶液 | 溶液变红 | 稀HNO3将铁氧化成Fe3+ |
| B | 某实验小组从资料上获得信息:Fe3+可以氧化银单质,他们用这种方法清洗一批做了银镜反应实验的试管,配制Fe3+的浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别用于清洗试管 | 用FeCl3溶液清洗比用Fe2(SO4)3溶液清洗干净 | Fe3+氧化银单质的过程可能是一个可逆过程:Fe3++Ag?Fe2++Ag+ |
| C | 在苯酚钠溶液中通入少量CO2气体 | 溶液变浑浊 | 碳酸的酸性比苯酚的强,溶液中还有Na2CO3生成 |
| D | 向硅酸钠溶液中滴入酚酞溶液,再滴加稀盐酸 | 溶液变红,后溶液红色变浅直至消失 | 非金属性:Cl>Si |
| A. | A | B. | B | C. | C | D. | D |
1.将铜和镁组成的2.24g混合物投入适量某浓度的硝酸中完全反应,还原产物中有NO2、NO、N2O三种气体,且体积均为0.224L(标准状况),然后向反应后的溶液中,加入足量的NaOH溶液,所得沉淀经过滤、洗涤、干燥后称量,质量为( )
| A. | 3.12g | B. | 4.28g | C. | 4.68g | D. | 5.08g |
18.膦(PH3)在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含之.它的分子是三角锥形.以下关于PH3的叙述中,正确的是( )
| A. | PH3是非极性分子 | |
| B. | PH3分子中有未成键的电子对 | |
| C. | PH3中的P-H键的极性比NH3中N-H键的极性弱 | |
| D. | PH3分子中的P-H键是非极性键 |
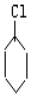 $→_{②}^{NaOH、乙醇}$
$→_{②}^{NaOH、乙醇}$ $→_{③}^{溴的CCl_{4}溶液}$B$\stackrel{④}{→}$
$→_{③}^{溴的CCl_{4}溶液}$B$\stackrel{④}{→}$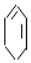

 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr+2H2O.
+2NaBr+2H2O.