题目内容
19.甲、乙、丙三位同学各设计了一个实验,结果各自都认为自己的试样中含有SO42-.甲的实验是:试样A(无色溶液)$\stackrel{加氯化钡溶液}{→}$白色沉淀$\stackrel{加足量盐酸}{→}$沉淀不溶解
(1)乙认为甲的实验不严谨,因为试样A中若含有Ag+离子,也会有此现象.
乙的实验是:试样B(无色溶液)$\stackrel{加硝酸钡溶液}{→}$白色沉淀$\stackrel{加足量稀硝酸}{→}$沉淀不溶解
(2)丙认为乙的实验不严谨,因为试样B中若含有SO32-离子,也会有此现象.
丙的实验是:试样C(无色溶液)$\stackrel{加试剂Ⅰ}{→}$显现Ⅰ$\stackrel{加试剂Ⅱ}{→}$显现Ⅱ
(3)若丙方案合理,则回答:其中试剂Ⅰ是盐酸,现象Ⅰ中肯定有描述是无沉淀和气体生成;试剂Ⅱ是BaCl2,现象Ⅱ是生成白色沉淀.
分析 检验SO42-常选用试剂氯化钡溶液和盐酸,观察是否产生不溶于酸的白色沉淀--硫酸钡.但是检验SO42-常会受到Ag+的干扰,因为当向待测溶液中滴加氯化钡溶液,如果待测溶液中存在Ag+,同样会产生一种不溶于酸的白色沉淀氯化银.
因此,在检验SO42-的过程中,为了排除Ag+的干扰,常先往溶液中滴加适量稀盐酸无现象后,再滴加氯化钡溶液,以此来解答.
解答 解:(1)乙认为甲的实验不严谨,因为试样A中若含有Ag+,它会和氯化钡溶液中的Cl-反应,产生不溶于酸的白色沉淀AgCl,
故答案为:Ag+;
(2)丙认为乙的实验也不严谨,因为试样B中若含有SO32-,加稀硝酸后,SO32-被硝酸氧化为SO42-,所以原溶液中可能没有SO42-,
故答案为:SO32-;
(3)为了排除Ag+和SO32-对SO42-检验的干扰,可以先往试样中滴加稀盐酸,如果无沉淀和气体生成,说明不存在Ag+和SO32-,再滴入氯化钡溶液,产生白色沉淀,则沉淀一定是硫酸钡,原试样中存在SO42-,则试剂I为盐酸,I中现象为无沉淀和气体生成,试剂II为BaCl2,II中现象为生成白色沉淀,
故答案为:盐酸;无沉淀和气体生成;BaCl2;生成白色沉淀.
点评 本题考查实验评价及常见离子的检验,为高频考点,把握离子检验的试剂、现象、结论为解答的关键,侧重分析与实验能力的考查,注意离子检验时排除干扰离子的影响,题目难度不大.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
7..京沪高速发生一起违章驾驶相撞,使槽罐车中35吨液氯快速泄漏,造成大批人员伤亡,大片农田被毁和重大经济损失的恶性事故.对于该事故发生时下列各种应急处理,你认为正确的是( )
| A. | 附近居民切忌惊慌,用毛巾护住口鼻,朝顺风方向或向避风的沟塘低洼处转移 | |
| B. | 要快速地将翻落的氯槽罐安全起吊移到水池,进行碱液稀释中和 | |
| C. | 液氯流淌速度很慢,居民不必惊慌,可以放心退到家中,关紧门窗 | |
| D. | 检修或现场抢救时,没有防毒面具,可以佩戴用浓碱溶液浸过的湿口罩 |
14.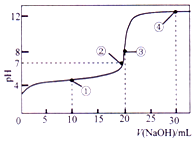 常温下,用 0.1000mol•L-1NaOH 溶液滴定 20.00mL 0.1000mol•L-1的 CH3COOH 溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用 0.1000mol•L-1NaOH 溶液滴定 20.00mL 0.1000mol•L-1的 CH3COOH 溶液所得滴定曲线如图.下列说法正确的是( )
 常温下,用 0.1000mol•L-1NaOH 溶液滴定 20.00mL 0.1000mol•L-1的 CH3COOH 溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用 0.1000mol•L-1NaOH 溶液滴定 20.00mL 0.1000mol•L-1的 CH3COOH 溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①所示的溶液中:c(Na+)+c(H+)>c(CH3COOH)+c(OH-) | |
| B. | 点②所示溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | 点③所示溶液中:c(H+)=c(CH3COOH)+c(OH-) | |
| D. | 点④所示溶液中:2c(OH-)-2c(H+)=c(CH3COO-)+3c(CH3COOH) |
4.某同学进行了硫代硫酸钠与硫酸反应的有关实验,实验过程的数据记录如表(见表格),请结合表中信息,回答有关问题:( Na2S2O3+H2SO4═Na2SO4+S↓+SO2↑+H2O)
(1)根据你所掌握的知识判断,在上述实验中,反应速率最快的可能是D(填实验序号).
(2)在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件,其中:
①能说明温度对该反应速率影响的组合是BD(填实验序号,下同);
②A和B、A和C的组合比较,所研究的问题是相同温度条件下浓度对该反应速率的影响;
③B和C的组合比较,所研究的问题是相同温度条件下,该反应速率更大程度上取决于哪种反应物的浓度
(3)教材中利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小进行比较:SO2可溶于水,测定不精确或实验装置较复杂,不易控制.
| 实验 序号 | 反应温 度/℃ | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
(2)在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件,其中:
①能说明温度对该反应速率影响的组合是BD(填实验序号,下同);
②A和B、A和C的组合比较,所研究的问题是相同温度条件下浓度对该反应速率的影响;
③B和C的组合比较,所研究的问题是相同温度条件下,该反应速率更大程度上取决于哪种反应物的浓度
(3)教材中利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小进行比较:SO2可溶于水,测定不精确或实验装置较复杂,不易控制.
8.化学与生活、能源、环境等密切相关.下列叙述正确的是( )
| A. | 油脂和蛋白质是人体必需的营养物质,都属于高分子化合物 | |
| B. | 食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是吸水防止食品变质 | |
| C. | 采用催化转化技术,可将汽车尾气中的一氧化碳和氮氧化物转化为无毒气体 | |
| D. | 中医古籍《肘后备急方》中“青蒿一握,以水二升渍,绞取汁,尽服之”启发了屠呦呦采用低温提取青蒿素,该提取过程属于化学变化 |
9.下列说法错误的是( )
| A. | 蒸馏可用于分离提纯液态有机混合物 | |
| B. | 乙烯和甲烷可用酸性KMnO4溶液鉴别 | |
| C. | 甲烷和氯气发生取代反应需要光照 | |
| D. | 核磁共振氢谱通常用于分析有机物的相对分子质量 |
 (或
(或
 ).
).