题目内容
15.3.87克锌铜合金完全溶解于150mL、密度为1.20g/cm3、质量分数为21%的稀硝酸中,得到NO气体896mL (标准状况),向反应后的溶液中加入适量的1.0mol/LNaOH溶液,恰使溶液中的金属离子全部沉淀.下列说法不正确是( )| A. | 该稀硝酸中HNO3的物质的量浓度是4.0mol/L | |
| B. | 加入NaOH溶液的体积是560mL | |
| C. | 被还原的硝酸的物质的量为0.04mol | |
| D. | 得到的金属氢氧化物的沉淀为5.81克 |
分析 A.根据c=$\frac{1000ρw}{M}$计算该浓硝酸的物质的量浓度;
B.加入适量的1.0mol/L NaOH溶液,恰使溶液中的金属离子全部沉淀,此时溶液中溶质为NaNO3,由N元素守恒可知n(NaNO3)+n(NO)=n(HNO3),由钠离子守恒n(NaOH)=n(NaNO3),再根据V=$\frac{n}{c}$计算;
C.起氧化性的硝酸被还原生成NO气体,根据N原子守恒可知,被还原的硝酸的物质的量等于一氧化氮的物质的量;
D.由电荷守恒可知,氢氧化物中氢氧根的物质的量等于转移电子物质的量,根据二氧化氮计算转移电子物质的量,氢氧化物质量等于金属质量与氢氧根质量之和.
解答 解:A.密度为1.20g/cm3、质量分数为21%的浓硝酸的物质的量浓度=$\frac{1000×1.2×21%}{63g/mol}$mol/L=4.0mol/L,故A正确;
B.加入适量的1.0mol/L NaOH溶液,恰使溶液中的金属离子全部沉淀,此时溶液中溶质为NaNO3,由N元素守恒可知n(NaNO3)+n(NO)=n(HNO3),则n(NaNO3)=0.15L×4mol/L-$\frac{0.896L}{22.4L/mol}$=0.56mol,由钠离子守恒n(NaOH)=n(NaNO3)=0.56mol,故需要1.0mol/L NaOH溶液体积为$\frac{0.56mol}{1.0mol/L}$=560ml,故B正确;
C.起氧化性的硝酸被还原生成NO气体,根据N原子守恒可知,被还原的硝酸的物质的量等于$\frac{0.896L}{22.4L/mol}$=0.04mol,故C正确;
D.由电荷守恒可知,氢氧化物中氢氧根的物质的量等于转移电子物质的量,即氢氧根的物质的量为0.04mol×(5-2)=0.12mol,故氢氧化物质量=3.87g+0.12mol×17g/mol=5.91g,故D错误,
故选D.
点评 本题考查混合物的有关计算,难度中等,理解反应发生的过程是关键,是对学生综合能力的考查,注意根据守恒思想进行的解答.

| A. | CH3CH2CH3 | B. | CH3COOH | C. | CH3COOCH3 | D. | CH3OCH3 |
| A. | 1:3:6 | B. | 2:1:6 | C. | 3:5:12 | D. | 1:1:6 |
| A. | 75% | B. | 50% | C. | 5% | D. | 12.5% |
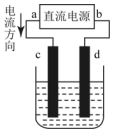
| A. | c极发生还原反应 | B. | 每生成6.4gCu,转移电子0.2mol | ||
| C. | 阳极反应式:Cu2++2e→Cu | D. | 在溶液中电子由d流向c |
| A. | 附近居民切忌惊慌,用毛巾护住口鼻,朝顺风方向或向避风的沟塘低洼处转移 | |
| B. | 要快速地将翻落的氯槽罐安全起吊移到水池,进行碱液稀释中和 | |
| C. | 液氯流淌速度很慢,居民不必惊慌,可以放心退到家中,关紧门窗 | |
| D. | 检修或现场抢救时,没有防毒面具,可以佩戴用浓碱溶液浸过的湿口罩 |
| 实验 序号 | 反应温 度/℃ | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
(2)在比较某一因素对实验产生的影响时,必须排除其他因素的变动和干扰,即需要控制好与实验有关的各项反应条件,其中:
①能说明温度对该反应速率影响的组合是BD(填实验序号,下同);
②A和B、A和C的组合比较,所研究的问题是相同温度条件下浓度对该反应速率的影响;
③B和C的组合比较,所研究的问题是相同温度条件下,该反应速率更大程度上取决于哪种反应物的浓度
(3)教材中利用了出现黄色沉淀的快慢来比较反应速率的快慢,请你分析为何不采用排水法测量单位时间内气体体积的大小进行比较:SO2可溶于水,测定不精确或实验装置较复杂,不易控制.
| A. |  检查气密性 检查气密性 | B. |  制备氨气 | C. |  吸收氨尾气 | D. |  喷泉实验 |