题目内容
19.下列反应的离子方程式书写正确的是( )| A. | 稀醋酸与氢氧化钠溶液的反应:H++OH-=H2O | |
| B. | 钠与水反应:Na+H2O=Na++OH-+H2↑ | |
| C. | 氯气与氯化亚铁溶液的反应:Cl2+2Fe2+=2Cl-+2Fe3+ | |
| D. | 碳酸钙溶液与足量稀盐酸的反应:CO32-+2H+=H2O+CO2↑ |
分析 A.醋酸在离子反应中保留化学式;
B.电子、原子不守恒;
C.反应生成氯化铁,遵循电子、电荷守恒;
D.碳酸钙在离子反应中保留化学式.
解答 解:A.稀醋酸与氢氧化钠溶液的反应的离子反应为CH3COOH+OH-=CH3COO-+H2O,故A错误;
B.钠与水反应的离子反应为2Na+2H2O=2Na++2OH-+H2↑,故B错误;
C.氯气与氯化亚铁溶液的反应的离子反应为Cl2+2Fe2+=2Cl-+2Fe3+,故C正确;
D.碳酸钙溶液与足量稀盐酸的反应的离子反应为CaCO3+2H+=Ca2++H2O+CO2↑,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电荷守恒,题目难度不大.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
9.下列关于有机物的说法正确的是( )
| A. | “西气东输”中的“气”主要成分是甲烷 | |
| B. | 乙烯的结构简式为CH2CH2 | |
| C. | 分子式为C6H6的物质一定是苯 | |
| D. | 乙烯使溴水褪色说明乙烯与溴发生了取代反应 |
10.金属钠着火时,可采用的灭火物质是( )
| A. | CO2 | B. | 水 | ||
| C. | 干沙 | D. | 干粉(含NaHCO3)灭火剂 |
14.人们通常把拆开1mol某物质的化学键所吸收的能量看作该物质的化学键的键能,键能的大小可以衡量化学键的相对强弱.由图判断,下列说法错误的是( )
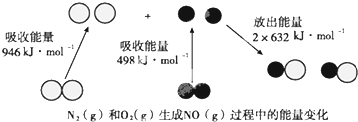

| A. | N≡N键的键能为946kJ•mol-1 | |
| B. | N2(g)+O2(g)═2NO(g)△H=+180kJ•mol-1 | |
| C. | 当有16gO2(g)参加反应时,该反应吸收90kJ热量 | |
| D. | 当有1mol电子发生转移时,该反应吸收90kJ热量 |
11.如图为元素周期表中短周期元素的一部分,下列关于Y、Z、M的说法正确的是( )
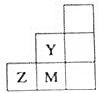

| A. | 非金属性:Y>Z>M | |
| B. | 离子半径:M->Z2->Y- | |
| C. | Z元素存在同素异形现象 | |
| D. | 三种元素中,Y的最高价氧化物对应的水化物酸性最强 |
 X、Y、Z、W为前四周期元素且原子序数依次增大,X的电子层数等于核外电子数,Y元素基态原子核外未成对电子数为2且X与Y形成的化合物在常温下为常见的液体R,Z元素原子最外电子层上s、p电子数相等,W基态原子3d轨道的电子数是4s轨道电子数的3倍.请回答下列问题:
X、Y、Z、W为前四周期元素且原子序数依次增大,X的电子层数等于核外电子数,Y元素基态原子核外未成对电子数为2且X与Y形成的化合物在常温下为常见的液体R,Z元素原子最外电子层上s、p电子数相等,W基态原子3d轨道的电子数是4s轨道电子数的3倍.请回答下列问题: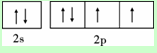 ,其第一电离能在同周期元素中由大到小排第4 位.
,其第一电离能在同周期元素中由大到小排第4 位.