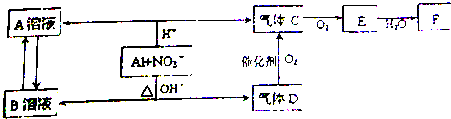
题目内容
4.实验室用6.5g锌和200g稀硫酸反应制取氢气.若恰好完全反应时计算:(1)所用锌的物质的量?
(2)在标准状况下产生氢气的体积?
(3)原硫酸溶液的质量分数是多少?
分析 (1)锌的物质的量n=$\frac{m}{M}$计算;
(2)反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑,根据化学方程式计算;
(3)反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑,根据化学方程式计算硫酸的质量,再根据质量分数=$\frac{m(溶质)}{m(溶液)}$×100%计算硫酸溶液的质量分数.
解答 解:6.5g锌的物质的量为$\frac{6.5g}{65g/mol}$=0.1mol,则
Zn+H2SO4=ZnSO4+H2↑
1mol 1mol 22.4L
0.1mol 0.1mol 2.24L
(1)6.5g锌的物质的量为$\frac{6.5g}{65g/mol}$=0.1mol,答:所用锌的物质的量为0.1mol;
(2)由方程式可知生成氢气的体积为2.24L,答:在标准状况下产生氢气的体积为2.24L;
(3)n(H2SO4)=0.1mol,则m(H2SO4)=0.1mol×98g/mol=9.8g,
所以原硫酸溶液的质量分数是$\frac{9.8g}{200g}$×100%=4.9%,
答:原硫酸溶液的质量分数是4.9%.
点评 本题考查化学方程式的计算,题目较为简单,注意有关计算公式的运用.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
14.表是元素周期表的一部分,用 化学式回答下列问题
(1)在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是Ar,除稀有气体外,原子半径最大的是K.
(2)所有元素的最高价氧化物对应的水化物中酸性最强的 物质是HClO4,碱性最强的 物质是KOH.
(3)③的最高价氧化物对应水化物的电子式为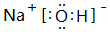 ,该物质和⑤的最高价氧化物对应水化物发生反应的化学反应方程式是NaOH+Al(OH)3=NaAlO2+2H2O
,该物质和⑤的最高价氧化物对应水化物发生反应的化学反应方程式是NaOH+Al(OH)3=NaAlO2+2H2O
(4)请说出③的金属性比④强的一个科学事实NaOH溶液碱性比Mg(OH)2强.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡ | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)所有元素的最高价氧化物对应的水化物中酸性最强的 物质是HClO4,碱性最强的 物质是KOH.
(3)③的最高价氧化物对应水化物的电子式为
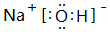 ,该物质和⑤的最高价氧化物对应水化物发生反应的化学反应方程式是NaOH+Al(OH)3=NaAlO2+2H2O
,该物质和⑤的最高价氧化物对应水化物发生反应的化学反应方程式是NaOH+Al(OH)3=NaAlO2+2H2O(4)请说出③的金属性比④强的一个科学事实NaOH溶液碱性比Mg(OH)2强.
19.下列反应的离子方程式书写正确的是( )
| A. | 稀醋酸与氢氧化钠溶液的反应:H++OH-=H2O | |
| B. | 钠与水反应:Na+H2O=Na++OH-+H2↑ | |
| C. | 氯气与氯化亚铁溶液的反应:Cl2+2Fe2+=2Cl-+2Fe3+ | |
| D. | 碳酸钙溶液与足量稀盐酸的反应:CO32-+2H+=H2O+CO2↑ |
9.某有机物(仅含碳、氢、氧)的相对分子量在50~100之间,经分析得知,其中氧质量分数为36.37%.有关其同分异构体数目的说法错误的是( )
| A. | 属于酯类的有4种 | |
| B. | 属于羧酸的有2种 | |
| C. | 既含有羟基又含有醛基的有3种 | |
| D. | 存在分子中含有六元环的同分异构体 |
16.化学与环境保护密切相关,下列叙述正确的是( )
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | PM2.5(2.5微米以下的细颗粒物)主要来自化石燃料的燃烧 | |
| C. | 处理废水时加入明矾作为消毒剂对水进行杀菌消毒 | |
| D. | 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2 |
13.我国首部《食品安全法》于2009年6月1日起颁布施行.下列能保证食品安全的是( )
| A. | 用小苏打作发酵粉焙制糕点 | B. | 用甲醛溶液浸泡海产品 | ||
| C. | 用工业石蜡给水果上蜡“美容” | D. | 用工业酒精勾兑饮用酒 |
6.中美科学家研制的某快充电池工作原理如图所示.电解质为一种常温离子液体(由有机阳离子、Al2Cl7-和AlCl4-组成),在电池充、放电过程中,不产生其他离子且有机阳离子不参与电极反应.下列有关该快充电池的说法错误的是( )
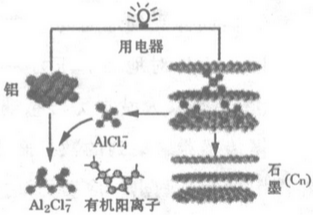

| A. | 放电时铝为电池阳极 | |
| B. | 充电时AlCl4-移向石墨电极 | |
| C. | 铝电极的比能量较高 | |
| D. | 充电时铝电极上的反应为Al+7AlCl4--3e-=4Al2Cl7- |