题目内容
14.用O2将HCl转化为Cl2,反应方程式为:4HCl(g)+O2(g)?2H2O(g)+2Cl2(g)△H>0 一定条件下在1L密闭容器中测得反应过程中n(Cl2)的实验数据如表.下列说法正确的是( )| t/min | 0 | 2 | 4 | 6 |
| n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
| A. | 0~2 min的反应速率小于4~6 min的反应速率 | |
| B. | 2~6 min用Cl2表示的反应速率为0.9 mol/(L•min) | |
| C. | 降低温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| D. | 平衡常数:K(200℃)<K(400℃) |
分析 A.开始浓度大,反应速率快,后来浓度小反应速率慢;
B.结合v=$\frac{△c}{△t}$计算;
C.该反应为吸热反应,降低温度平衡逆向移动;
D.该反应为吸热反应,升高温度,平衡正向移动,K增大.
解答 解:A.开始浓度大,反应速率快,后来浓度小反应速率慢,或由表格中数据变化可知0~2 min的反应速率大于4~6 min的反应速率,故A错误;
B2~6 min用Cl2表示的反应速率为$\frac{\frac{(5.4-1.8)×1{0}^{-3}mol}{1L}}{4min}$=0.9×10-3mol/(L•min),故B错误;
C.该反应为吸热反应,降低温度平衡逆向移动,正逆反应速率均减小,故C错误;
D.该反应为吸热反应,升高温度,平衡正向移动,K增大,则平衡常数:K(200℃)<K(400℃),故D正确;
故选D.
点评 本题考查化学平衡的计算,为高频考点,把握表格数据应用、速率计算、K与温度关系、平衡移动为解答的关键,侧重分析与计算能力的考查,注意平衡移动原理的应用,题目难度不大.

练习册系列答案
相关题目
4.现有A、B、C、D、E五种溶液分别是盐酸、醋酸、氢氧化钠溶液、氨水、碳酸钠溶液中的一种.常温下进行下列实验:
(1)A的溶质是Na2CO3,D的溶质是HC1,E的溶质是NaOH(均填化学式)
(2)将等体积、等物质的量浓度的D、E分别与足量的铝粉反应,相同条件下产生氢气的体积之比为1:3.
(3)将等体积、等物质的量浓度的B和C混合后所得溶液的PH为7,又己知醋酸的酸性强于碳酸,由此可推断碳酸氢铵水溶液呈碱(填“酸”、“碱”或“中”)性.
(4)将D溶液逐滴滴加到A溶液中,当滴入的D的物质的量与A相等时,溶液中所有阴离子的物质的量浓度由大到小的关系为c(Cl-)>c(HCO3-)>c(OH-)>c(CO32-).
| 序号 | 实验步骤和结论 |
| ① | 比较浓度均为0.1mol•L-1的A和E的pH的大小为:7<A<E |
| ② | 1L pH=9的A分别与x L 0.001mol•L-1 B,y L 0.001mol•L-1D充分反应后,当溶液均呈中性时x、y的大小关系为:y<x; |
| ③ | pH=a的C与pH=b的D,且a+b=14,等体积混合发生酸碱中和反应后,溶液呈碱性. |
(2)将等体积、等物质的量浓度的D、E分别与足量的铝粉反应,相同条件下产生氢气的体积之比为1:3.
(3)将等体积、等物质的量浓度的B和C混合后所得溶液的PH为7,又己知醋酸的酸性强于碳酸,由此可推断碳酸氢铵水溶液呈碱(填“酸”、“碱”或“中”)性.
(4)将D溶液逐滴滴加到A溶液中,当滴入的D的物质的量与A相等时,溶液中所有阴离子的物质的量浓度由大到小的关系为c(Cl-)>c(HCO3-)>c(OH-)>c(CO32-).
5.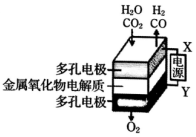 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )| A. | 阴极的反应式是:H2O+2e-=H2+O2-、CO2+2e-=CO+O2- | |
| B. | X是电源的负极 | |
| C. | 总反应可表示为:H2O+CO2=H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:1 |
2.饱和氯水长期放置后,下列微粒在溶液中不减少的是( )
| A. | HClO | B. | Cl- | C. | Cl2 | D. | ClO- |
9.已知单质碘受热易升华.从海带中提取碘的实验过程中涉及下列操作正确的是( )
| A. |  灼烧海带 | B. |  过滤得含I-的溶液 | ||
| C. |  放出碘的苯溶液 | D. | 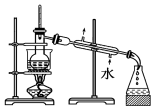 分离碘并回收苯 |
19.化学与科学、技术、社会、环境密切相关,下列有关说法中错误的是( )
| A. | 2010 年 11 月广州亚运会燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 合金的硬度一般比它的各成分金属的小,多数合金的熔点一般也比它的各成分金属 的高 | |
| C. | 小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| D. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁 |
6.下列有关 Na2CO3 和 NaHCO3 的说法错误的是( )
| A. | 等质量 Na2CO3 和 NaHCO3 分别和足量盐酸反应,相同条件下前者生成 CO2 少 | |
| B. | 将石灰水分别加入 NaHCO3 和 Na2CO3 中,前者不生成沉淀 | |
| C. | 相同条件下 Na2CO3 比 NaHCO3 更易溶于水 | |
| D. | Na2CO3 固体中含少量 NaHCO3,可用加热法除去 |
3.在Na2CO3溶液中,下列等量关系成立的是( )
| A. | c(OH-)=c(HCO3-)+c(H2CO3) | B. | 2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | ||
| C. | c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | D. | c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) |
4.Na-S电池的结构如图所示,电池反应为2Na+$\frac{n}{8}$S8=Na2Sn.下列说法不正确的是( )

| A. | 熔钠电极作电池的正极 | |
| B. | 放电时Na+向正极移动 | |
| C. | 充电时熔钠电极与电源的正极相连 | |
| D. | 充电时阳极反应式为8Sn2--16e-=nS8 |