题目内容
1.已知 298K 时,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,推测含 1molCH3COOH 的稀溶液与含 1mol NaOH 的稀溶液反应放出的热量( )| A. | 大于 57.3 kJ | B. | 等于 57.3 kJ | C. | 小于 57.3 kJ | D. | 无法确定 |
分析 依据中和热的概念和实质分析判断,中和热是指强酸、强碱的稀溶液完全反应生成1mol水时放出的热量,醋酸是弱酸存在电离平衡,随反应进行电离过程是吸热过程;
解答 解:在稀溶液中,强酸跟强碱发生中和反应生成1 mol水时的反应热叫做中和热,1molCH3COOH 的稀溶液与含 1mol NaOH 的稀溶液反应生成1mol水,但是醋酸是弱酸,电离需要吸热,所以反应放出的热量小于57.3kJ/mol,
故选C.
点评 本题主要考查了中和热的概念的理解,注意弱电解质电离吸热是解题的关键,题目较简单.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
9.下列叙述正确的是( )
| A. | 氯化钠溶液在电流作用下电离成钠离子和氯离子. | |
| B. | 硫酸钡难溶于水,但硫酸钡是电解质 | |
| C. | 溶于水后电离出氢离子的化合物都是酸 | |
| D. | 二氧化碳的水溶液能导电,故二氧化碳属于电解质 |
13.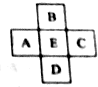 原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、O族元素除外)( )
原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、O族元素除外)( )
 原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、O族元素除外)( )
原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、O族元素除外)( )| A. | 4x | B. | 4x+6 | C. | 4x+10 | D. | 4x+14 |
14.某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-.分别取样:①加入浓氢氧化钠溶液,产生有刺激性气味的气体;②加氯水和淀粉无明显现象.为确定该溶液的组成,还需检验的离子是( )
| A. | Na+ | B. | SO42- | C. | Ba2+ | D. | NH4+ |
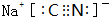 .
. ,它的化学键属于共价键;含有离子键和共价键的化合物的化学式为Na2O2.
,它的化学键属于共价键;含有离子键和共价键的化合物的化学式为Na2O2.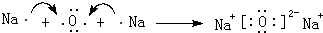 .
.