题目内容
4. (1)写出明矾[KAl(SO4)2•12H2O]在水中的电离方程式KAl(SO4)2•12H2O=K++Al3++2SO42-+12H2O,明矾净水的原因是因为它与水反应产生的Al(OH)3胶体具有吸附性.
(1)写出明矾[KAl(SO4)2•12H2O]在水中的电离方程式KAl(SO4)2•12H2O=K++Al3++2SO42-+12H2O,明矾净水的原因是因为它与水反应产生的Al(OH)3胶体具有吸附性.(2)溶液的导电能力大小主要是由离子浓度大小决定的,利用“液体导电性的实验装置”(如图所示)作下列实验,灯泡能出现由亮-暗-熄灭-亮现象的是B
A.向BaCl2溶液中滴入稀H2SO4
B.向Ba(OH)2溶液中滴入稀H2SO4
C.向NaOH溶液中滴入盐酸
写出所选项的离子反应方程式Ba2++2OH-+2 H++SO42-=BaSO4↓+2H2O (若上题选错,该项不得分).
(3)已知氯气与热烧碱溶液反应如下:3Cl2+6NaOH═NaClO3+5NaCl+3H2O,
①用双线桥法标出电子转移的方向和数目.
②当有0.1mol电子转移时,参加反应的Cl2在标准状况下的体积1344mL.
分析 (1)明矾是复盐,属于强电解质,在溶液中完全电离出钾离子、铝离子、硫酸根离子,由此可写出明矾电离的离子方程式;氢氧化铝胶体具有吸附性;
(2)向Ba(OH)2溶液中滴入稀H2SO4,生成硫酸钡沉淀和水,二者恰好反应时溶液的导电性几乎为零,继续加硫酸,溶液的导电性又增强;
(3)在反应3Cl2+6NaOH═5NaCl+NaClO3+3H2O中,化合价升高和降低的元素均是氯元素,化合价由0价分别变化为+5价、-1价,结合电子与氯气的关系计算.
解答 解:(1)明矾含有铝离子和钾离子两种阳离子,属于复盐,所以明矾是强电解质,在溶液中完全电离出钾离子、铝离子和硫酸根离子,电离方程式为:KAl(SO4)2•12H2O=K++Al3++2SO42-+12H2O;氢氧化铝胶体具有吸附性,能吸附水中的悬浮颗粒,从而起到净水作用;
故答案为:KAl(SO4)2•12H2O=K++Al3++2SO42-+12H2O;吸附;
(2)A.向BaCl2溶液中滴入稀H2SO4,生成硫酸钡沉淀和HCl,溶液中离子浓度还较大,所以灯泡不会熄灭,故A错误;
B.向Ba(OH)2溶液中滴入稀H2SO4,生成硫酸钡沉淀和水,溶液中离子浓度逐渐减小,灯泡变暗,二者恰好反应时溶液的导电性几乎为零,灯泡熄灭,继续加硫酸,溶液的导电性又增强,灯泡又变亮,故B正确;
C.向NaOH溶液中滴入盐酸,生成NaCl,溶液中离子浓度变化不大,灯泡不会熄灭,故C错误;
向Ba(OH)2溶液中滴入稀H2SO4,生成硫酸钡沉淀和水,反应的离子方程式为:Ba2++2OH-+2 H++SO42-=BaSO4↓+2H2O;
故答案为:B;Ba2++2OH-+2 H++SO42-=BaSO4↓+2H2O;
(3)①在反应3Cl2+6NaOH═5NaCl+NaClO3+3H2O中,化合价升高和降低的元素均是氯元素,在反应的3mol氯气中,有$\frac{1}{3}$mol的氯气做还原剂,有$\frac{5}{3}$mol的氯气做氧化剂,该反应转移电子为5mol,化合价升高的氯元素对应的产物NaClO3是氧化产物,电子转移的方向和数目可表示为 ,
,
故答案为: ;
;
②在反应3Cl2+6NaOH═5NaCl+NaClO3+3H2O中,转移电子为5mol,当有0.1mol电子转移时,参加反应的Cl2的物质的量为0.06mol,标准状况下的体积为1344mL;
故答案为:1344.
点评 本题考查了电离方程式、溶液的导电性、氧化还原反应,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度认识相关概念并把握物质的性质,难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | Na+ | B. | SO42- | C. | Ba2+ | D. | NH4+ |
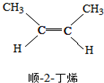 ?
? △H=-4.2kJ/mol.
△H=-4.2kJ/mol.| A. | 顺-2-丁烯比反-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热比反-2-丁烯大 | |
| C. | 降温有利于平衡向生成顺-2-丁烯反应方向移动 | |
| D. | 反-2-丁烯和顺-2-丁烯具有相同的熔沸点 |
| A. | I-131:${\;}_{19}^{39}X$ | B. | Cl-的结构示意图: | ||
| C. | 强电解质:BaSO4 | D. | 碱性氧化物:Na2O2 |
| A. | 既能与酸又能与碱反应的物质一定是两性氧化物或两性氢氧化物 | |
| B. | 阳离子一定有氧化性,可能有还原性 | |
| C. | FeCl3溶液和Fe(OH)3胶体的共性是都能产生丁达尔效应 | |
| D. | 某物质溶于水后所得溶液能导电,该物质一定属于电解质 |
| A. | X>Y | B. | W>Z | C. | Z>Y | D. | Z>X |
| A. | Na2O2中阴、阳离子的个数比为1:1 | |
| B. | Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等 | |
| C. | Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等 | |
| D. | Na2O2中氧的化合价为-2 |
| A. | 2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO | B. | 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe | ||
| C. | 2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑ | D. | NaOH+Al(OH)3═NaAlO2+2H2O |
 ,名称是3-甲基-1-丁炔;
,名称是3-甲基-1-丁炔; ;
;