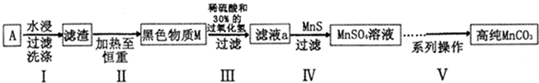
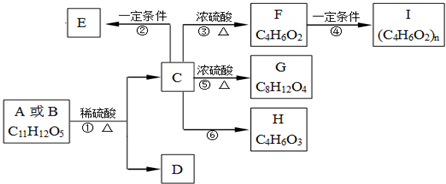
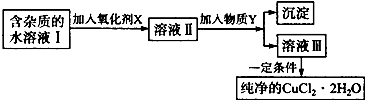
题目内容
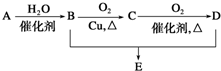
已知:A、B、C均为常见的单质或化合物,它们在一定条件下有如下关系A+H2O→B+C
(1)若A可作为呼吸面具和潜水艇中氧气的来源,则A与水反应的方程式为 ;
(2)若A、B、C均为化合物,且B是酸,则该反应的化学方程式为 ;
(3)若B、C均为酸,则该反应的化学方程式为 ;
(4)若C为H2.B为氧化物,则A可能是(填化学式) 、 、 .
(1)若A可作为呼吸面具和潜水艇中氧气的来源,则A与水反应的方程式为
(2)若A、B、C均为化合物,且B是酸,则该反应的化学方程式为
(3)若B、C均为酸,则该反应的化学方程式为
(4)若C为H2.B为氧化物,则A可能是(填化学式)
考点:无机物的推断
专题:
分析:(1)若A可作为呼吸面具和潜水艇中氧气的来源,应为Na2O2和水的反应,则A为Na2O2,B为NaOH,C为O2;
(2)若A、B、C均为化合物,且B是酸,应为NO2与H2O的反应,A为NO2,B为HNO3,C为NO;
(3)若B、C均为酸,常见为氯气和水的反应,生成盐酸和次氯酸;
(4)若C为H2.B为氧化物,则A可能为Fe、C、CO.
(2)若A、B、C均为化合物,且B是酸,应为NO2与H2O的反应,A为NO2,B为HNO3,C为NO;
(3)若B、C均为酸,常见为氯气和水的反应,生成盐酸和次氯酸;
(4)若C为H2.B为氧化物,则A可能为Fe、C、CO.
解答:
解:(1)若A可作为呼吸面具和潜水艇中氧气的来源,应为Na2O2和水的反应,则A为Na2O2,B为NaOH,C为O2,反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;
(2)若A、B、C均为化合物,且B是酸,应为NO2与H2O的反应,A为NO2,B为HNO3,C为NO,该反应的化学方程式为3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
(3)若B、C均为酸,常见为氯气和水的反应,生成盐酸和次氯酸,反应的方程式为Cl2+H2O=HCl+HClO,
故答案为:Cl2+H2O=HCl+HClO;
(4)若C为H2,B为氧化物,则A可能为Fe,反应3Fe+4H2O
Fe3O4+H2;A可能为C,反应C+H2O
CO+H2;A可能为CO,反应CO+H2O
CO2+H2,
故答案为:Fe;C;CO.
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;
(2)若A、B、C均为化合物,且B是酸,应为NO2与H2O的反应,A为NO2,B为HNO3,C为NO,该反应的化学方程式为3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
(3)若B、C均为酸,常见为氯气和水的反应,生成盐酸和次氯酸,反应的方程式为Cl2+H2O=HCl+HClO,
故答案为:Cl2+H2O=HCl+HClO;
(4)若C为H2,B为氧化物,则A可能为Fe,反应3Fe+4H2O
| ||
| ||
| ||
故答案为:Fe;C;CO.
点评:本题考查无机物的推断,侧重于元素及其化合物性质的考查,注意把握反应的特点以及转化关系,难度不大.

练习册系列答案
相关题目
我国著名化学家徐光宪因在稀土元素研究领域作出突出贡献荣获2008 年“国家最高科学技术奖”.稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应.已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+.下列说法正确的是( )
| A、电解熔融CeO2制Ce,铈在阳极获得 | ||||||||
| B、铈溶于氢碘酸的化学方程式可表示为:Ce+4HI═CeI4+2H2↑ | ||||||||
| C、用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+ | ||||||||
D、四种稳定的核素
|
 有机物A的产量是衡量一个国家石油工业发展水平的标志,可发生以下系列转化,B、D是生活中常见的两种有机物,下列说法不正确的是( )
有机物A的产量是衡量一个国家石油工业发展水平的标志,可发生以下系列转化,B、D是生活中常见的两种有机物,下列说法不正确的是( )| A、A的结构简式为CH2=CH2 |
| B、1molB物质可以与足量Na反应生成0.5molH2 |
| C、B、D、E三种物质可以用饱和Na2CO3溶液鉴别 |
| D、由B、D制备E浓H2SO4只作吸水剂 |
 某同学用如图所示装置探究SO2的性质及其有关实验.
某同学用如图所示装置探究SO2的性质及其有关实验.