题目内容
17.磁性氧化铁(Fe3O4)的组成可写成FeO•Fe2O3.某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质).探究过程如下:▲提出假设:假设1.黑色粉末是CuO;假设2.黑色粉末是Fe3O4;
假设3.黑色粉末是CuO和Fe3O4的混合物.
▲探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂.
①若假设1成立,则实验现象是溶液显蓝色.
②若所得溶液显血红色,则假设2或3成立.
③为进一步探究,继续向所得溶液加入足量铁粉,若产生有红色固体析出现象,则假设3成立.
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显.查阅资料:
Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3•H2O═Cu(NH3)42++4H2O.
④为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生红褐色沉淀现象;若产生红褐色沉淀,同时溶液呈深蓝色现象,则假设3成立.
分析 依据物质的颜色结合假设1和假设2解答;
①硫酸与氧化铜反应生成硫酸铜,硫酸铜溶液呈蓝色;
②三价铁离子遇到KSCN显血红色,据此解答;
③铁粉与铜离子反应置换出铜;
④如果假设2成立,则加入硫酸后得到的溶液中含有三价铁离子,加入氨水后生成氢氧化铁红褐色沉淀;如果假设3成立则加入硫酸后溶液中既含有三价铁离子还含有铜离子,加入足量氨水反应生成氢氧化铁红褐色沉淀;铜离子与氨水发生反应Cu2++4NH3•H2O═Cu(NH3)42++4H2O,盐酸变为深蓝色
解答 解:该物质是黑色固体,也可能既含有CuO又含有Fe3O4黑色粉末,是CuO和Fe3O4的混合物;
故答案为:黑色粉末是CuO和Fe3O4的混合物;
①硫酸与氧化铜发生反应:CuO+H2SO4=CuSO4+H2O,硫酸铜溶液显蓝色,若假设1成立,实验现象为:溶液显蓝色,
故答案为:溶液显蓝色;
②三价铁离子与KSCN试剂络合成红色络合物,所以如果所得溶液显血红色,证明加入硫酸后生成了三价铁离子,说明黑色物质中含有Fe3O4,所以假设2或3都有可能,
故答案为:2或3;
③铁粉与铜离子发生反应:2Cu2++Fe=3Fe2++Cu,所以如果产生红色物质,证明溶液中存在铜离子,则黑色固体中含有CuO
,故假设3正确;
故答案为:有红色固体析出;
④如果假设2成立,则加入硫酸后得到的溶液中含有三价铁离子,加入氨水后生成氢氧化铁红褐色沉淀;如果假设3成立则加入硫酸后溶液中既含有三价铁离子还含有铜离子,加入足量氨水反应生成氢氧化铁红褐色沉淀;铜离子与氨水发生反应Cu2++4NH3•H2O═Cu(NH3)42++4H2O,盐酸变为深蓝色,
故答案为:红褐色沉淀;红褐色沉淀,同时溶液呈深蓝色.
点评 本题考查了探究物质组成的方法,题目难度中等,明确实验目的、实验原理为解答关键,注意熟练掌握常见元素及其化合物性质,试题培养了学生的分析能力及化学实验能力.

 步步高达标卷系列答案
步步高达标卷系列答案| A. | N2 | B. | O2 | C. | .NaCl | D. | H2SO4溶液 |
| 选项 | ① | ② | ③ | 实验结论 | 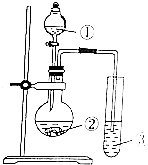 |
| A | 浓醋酸 | 石灰石 | Na2SiO3溶液 | 酸性:醋酸>碳酸>硅酸 | |
| B | 浓盐酸 | KMnO4 | KBr溶液 | 氧化性:KMnO4>Cl2>Br2 | |
| C | 稀硫酸 | FeS | SO2水溶液 | BaS可还原SO2 | |
| D | 盐浓酸 | 浓硫酸 | BaSO3悬浊液 | BaSO3可溶于盐酸 |
| A. | A | B. | B | C. | C | D. | D |

| A. | 当该卤代烃发生取代反应时,被破坏的键是①和③ | |
| B. | 当该卤代烃发生消去反应时,被破坏的键是①和③ | |
| C. | 当该卤代烃发生水解反应时,被破坏的键② | |
| D. | 当该卤代发生消去反应时,被破坏的键是①和② |
| A. | 5 | B. | 6 | C. | 7 | D. | 8 |
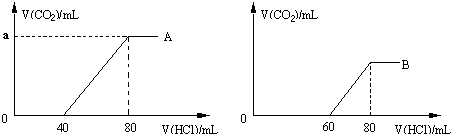
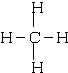 B.乙烯
B.乙烯
 2NH3
2NH3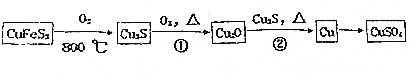
 如图为两套实验装置.
如图为两套实验装置.