题目内容
5.下列各组离子,能在溶液中大量共存的是( )| A. | K+、H+、SO42-、OH- | B. | Na+、H+、Cl-、SO42- | ||
| C. | Na+、Ca2+、CO32-、NO3- | D. | Ba2+、Cu2+、Cl-、SO42- |
分析 根据离子之间不能结合生成沉淀、气体、水等,则离子大量共存,并结合离子的颜色来解答.
解答 解:A.H+、OH-结合生成水,不能共存,故A不选;
B.该组离子之间不反应,可大量共存,故B选;
C.Ca2+、CO32-结合生成沉淀,不能共存,故C不选;
D.Ba2+、SO42-结合生成沉淀,不能共存,故D不选;
故选B.
点评 本题考查离子共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列实验操作对应的现象或结论不正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将KI和H2O2溶液在试管中混合后,加入苯萃取,振荡,静置 | 上层溶液呈紫红色 | 氧化性:H2O2>I2 |
| B | 将刚刚用砂纸打磨过的铝箔放在酒精灯上加热 | 铝箔熔化,但不滴落 | 铝易被氧化;铝的熔点比氧化铝低 |
| C | 常温下,用pH试纸测量某浓度的NaHSO3溶液的pH | pH约为5.5 | 该溶液中的HSO3-的电离程度大于它的水解程度 |
| D | 向盛Mg(OH)2悬浊液的试管中加入适量NH4Cl浓溶液 | 溶液变澄清 | Mg(OH)2与NH4Cl溶液发生氧化还原反应 |
| A. | A | B. | B | C. | C | D. | D |
16.工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)=CH3OH(g)△H1(CO结构式为C≡O).又知某些化学键的键能(断开1mol化学键时所需要的最低能量)数值如表:则△H1=-116kJ•mol-1
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
13.下列说法中正确的是( )
| A. | SiO2既能溶于NaOH溶液又能溶于氢氟酸,说明SiO2是两性氧化物 | |
| B. | 将Cu片置于浓H2SO4中,无明显现象,说明Cu在冷的浓硫酸中被钝化 | |
| C. | “雷雨发庄稼”的实质是自然固氮 | |
| D. | 自来水厂可用明矾对水进行杀菌消毒 |
20.下列说法正确的是( )
| A. | 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同 | |
| B. | 配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度 | |
| C. | 用加热的方法可以除去KCl溶液中的Fe3+ | |
| D. | 锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除 |
10.下列说法正确的是( )
| A. | 失电子越多,还原性就越强,得电子越多,氧化性越强 | |
| B. | 金属单质在化学反应中一定作为还原剂,非金属单质在反应中可以作氧化剂 | |
| C. | 强电解质溶液的导电能力一定强,弱电解质溶液的导电能力一定弱 | |
| D. | 凡是强酸和强碱反应的离子方程式都可以用H++OH-=H2O表示 |
17.溴乙烷中混有杂质乙醇,除去乙醇的方法是( )
| A. | 加热蒸发 | B. | 过滤 | C. | 加水、萃取、分液 | D. | 加苯、萃取、分液 |
14.三氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是( )
| A. | 氯化硼液态时能导电而固态时不导电 | |
| B. | 硼原子以sp3杂化 | |
| C. | 氯化硼分子属极性分子 | |
| D. | 氯化硼遇水蒸气会产生白雾 |
15.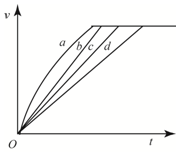 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实现条件,下列说法中一定不正确的是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实现条件,下列说法中一定不正确的是( )
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实现条件,下列说法中一定不正确的是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实现条件,下列说法中一定不正确的是( )| 组别 | 对应曲线 | c(HCl)/mol•L-1 | 反应温度/℃ | 铁的状态 |
| 1 | a | 30 | 粉末状 | |
| 2 | b | 30 | 粉末状 | |
| 3 | c | 2.5 | 块状 | |
| 4 | d | 2.5 | 30 | 块状 |
| A. | 第1组实验中盐酸的浓度大于2.5mol•L-1 | |
| B. | 第2组实验中盐酸的浓度大于2.5mol•L-1 | |
| C. | 第3组实验的反应温度低于30℃ | |
| D. | 第4组实验的反应速度最慢 |