题目内容
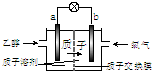 一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在200℃左右时供电(如图所示),比甲醇电池效率高出32倍,且安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O.则下列说法正确的是( )
一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在200℃左右时供电(如图所示),比甲醇电池效率高出32倍,且安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O.则下列说法正确的是( )| A、a极为电池的正极 |
| B、电池正极的电极反应:4H++O2+4e-=2H2O |
| C、电池工作时电子由b极沿导线经灯泡再到a极 |
| D、设每个电子所带电量为q库仑,则1mol乙醇被氧化产生6q×6.02×1023库仑的电量 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:由质子的定向移动可知a为负极,b为正极,负极发生氧化反应,乙醇被氧化生成CO2和,电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,正极氧气得到电子被还原,电极反应式为4H++O2+4e-=2H2O,结合电极反应解答该题.
解答:
解:A.根据质子移动方向知,a是负极,b是正极,故A错误;
B.正极上氧气得电子和氢离子反应生成水,电极反应式为4H++O2+4e-=2H2O,故B正确;
C.a是负极,b是正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,则电子从负极沿导线流向正极,故C错误;
D.1mol乙醇被氧化失去12mol电子,则1mol乙醇被氧化产生12NAq厍仑的电量,故D错误;
故选B.
B.正极上氧气得电子和氢离子反应生成水,电极反应式为4H++O2+4e-=2H2O,故B正确;
C.a是负极,b是正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,则电子从负极沿导线流向正极,故C错误;
D.1mol乙醇被氧化失去12mol电子,则1mol乙醇被氧化产生12NAq厍仑的电量,故D错误;
故选B.
点评:本题考查了原电池原理,根据质子移动方向确定正负极,再结合正负极上得失电子书写电极反应式,难点是电极反应式的书写,也为易错点.

练习册系列答案
相关题目
常温下,下列酸碱发生中和反应,有关判断正确的是( )
| A、同浓度的NaOH溶液和CH3COOH溶液等体积混合后,c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| B、pH=3的CH3COOH溶液和pH=11的KOH溶液等体积混合,c(K+)>c(CH3COO-)>c(OH-)>c(H+) |
| C、pH=2的HNO3溶液与pH=12的NH3?H2O溶液等体积混合,c(NH4+)+c(H+)=c(OH-)+c(NO3-) |
| D、pH=2的盐酸与pH=11的NaOH溶液按体积比2:9混合,混合液pH=3.2 |
苯可被臭氧分解,发生反应: 二甲苯通过上述反应所得产物可能为:
二甲苯通过上述反应所得产物可能为: 若邻二甲苯进行上述反应,对其反应产物描述正确的是( )
若邻二甲苯进行上述反应,对其反应产物描述正确的是( )
 二甲苯通过上述反应所得产物可能为:
二甲苯通过上述反应所得产物可能为: 若邻二甲苯进行上述反应,对其反应产物描述正确的是( )
若邻二甲苯进行上述反应,对其反应产物描述正确的是( )| A、产物为a、b、c,其分子个数比为a:b:c=1:2:3 |
| B、产物为a、b、c,其分子个数比为a:b:c=1:2:1 |
| C、产物为a和c,其分子个数比为a:c=1:2 |
| D、产物为b和c,其分子个数比为b:c=2:1 |
下列反应中必须加入氧化剂才能进行的是( )
| A、Fe2+→Fe3+ |
| B、CO32-→CO2 |
| C、SO32-→HSO3- |
| D、MnO4-→Mn2+ |
在500mL1mol/L的CuSO4溶液中投入一块铁片,过一段时间后,取出铁片,洗净、干燥后称质量,铁片增加了0.8g,析出铜的质量是( )
| A、0.8g | B、6.4g |
| C、7.0g | D、4.8g |
将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁.下列结论不正确的是( )
| A、该反应为吸热反应 |
| B、该反应为放热反应 |
| C、铁粉与硫粉常温下不反应 |
| D、生成物硫化亚铁的总能量小于反应物铁粉和硫粉的总能量 |
