题目内容
在500mL1mol/L的CuSO4溶液中投入一块铁片,过一段时间后,取出铁片,洗净、干燥后称质量,铁片增加了0.8g,析出铜的质量是( )
| A、0.8g | B、6.4g |
| C、7.0g | D、4.8g |
考点:化学方程式的有关计算
专题:
分析:发生反应:Fe+CuSO4═FeSO4+Cu,利用固体差量法来计算.
解答:
解:设析出的Cu的质量为x,则
Fe+CuSO4═FeSO4+Cu 质量增大△m
64 64-56=8
x 0.8g
所以x=
=6.4g,
故选B.
Fe+CuSO4═FeSO4+Cu 质量增大△m
64 64-56=8
x 0.8g
所以x=
| 0.8g×64 |
| 8 |
故选B.
点评:本题考查学生化学反应方程式的计算,理解固体质量变化及差量法来计算是解答本题的关键,难度不大.

练习册系列答案
相关题目
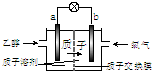 一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在200℃左右时供电(如图所示),比甲醇电池效率高出32倍,且安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O.则下列说法正确的是( )
一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在200℃左右时供电(如图所示),比甲醇电池效率高出32倍,且安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O.则下列说法正确的是( )| A、a极为电池的正极 |
| B、电池正极的电极反应:4H++O2+4e-=2H2O |
| C、电池工作时电子由b极沿导线经灯泡再到a极 |
| D、设每个电子所带电量为q库仑,则1mol乙醇被氧化产生6q×6.02×1023库仑的电量 |
下列离子方程式不正确的是( )
| A、银氨溶液中加入足量盐酸产生沉淀:[Ag(NH3)2]++OH-+3H++Cl-=AgCl↓+2NH4++H2O |
| B、在亚硫酸钡沉淀中加入稀硝酸后,沉淀不溶解:3BaSO3+2H++2NO3-=3BaSO4↓+2NO↑+H2O |
| C、碳酸钠溶液中通入少量SO2:2CO32-+SO2+H2O=2HCO3-+SO32- |
| D、氧化铁可溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O |
有四组同族元素的物质,在101.3kPa时测定它们的沸点(℃)如表所示:下列说法中正确的是( )
| 第一组 | He-268.8 | (A)-249.5 | Ar-185.8 | Kr-151.7 |
| 第二组 | F2-187.0 | Cl2-33.6 | (B) 58.7 | I2 184.0 |
| 第三组 | (C) 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| 第四组 | H2O 100.0 | H2S-60.2 | (D)-42.0 | H2Te-1.8 |
| A、A、B、C的化学式分别为Ne2、Br2、HF |
| B、第二组物质在反应中只表现氧化性 |
| C、第三组物质中C的沸点最高,是因为C分子内存在氢键 |
| D、第四组中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te |
下列生产胆矾的实验设计能体现“经济、高效、环保”精神的是( )
| A、铜与浓硫酸共热后用水稀释 |
| B、先灼烧铜生成氧化铜,然后再加稀硫酸溶解 |
| C、用铜片作阳极,石墨作阴极,电解稀硫酸 |
| D、适当温度下,使铜片在持续通入空气的稀硫酸中加快腐蚀 |
重水D2O的离子积为1.6×10-15,可以用pH一样的定义来规定pD=-lgc(D+),以下关于pD的叙述正确的是( )
| A、中性溶液中pD=7 |
| B、在1LD2O的溶液中溶解0.01mol NaOD(设溶液的体积为1L),其中pD=12 |
| C、在1L D2O中溶解 0.01mol DCl (设溶液的体积为1L),其中pD=2 |
| D、在100 mL 0.25mol/L的DCl重水溶液中加入100 mL 0.2 mol/L的 NaOD的重水溶液,其中pD=1 |
 A、B、C、D都是中学常见的物质,在一定的条件下有如图所示的转化关系(未注明反应条件),请回答下列问题:
A、B、C、D都是中学常见的物质,在一定的条件下有如图所示的转化关系(未注明反应条件),请回答下列问题: ( 也可表示为:
( 也可表示为: )
)
