题目内容
常温下,下列酸碱发生中和反应,有关判断正确的是( )
| A、同浓度的NaOH溶液和CH3COOH溶液等体积混合后,c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| B、pH=3的CH3COOH溶液和pH=11的KOH溶液等体积混合,c(K+)>c(CH3COO-)>c(OH-)>c(H+) |
| C、pH=2的HNO3溶液与pH=12的NH3?H2O溶液等体积混合,c(NH4+)+c(H+)=c(OH-)+c(NO3-) |
| D、pH=2的盐酸与pH=11的NaOH溶液按体积比2:9混合,混合液pH=3.2 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A、NaOH是强碱,CH3COOH是弱酸,等体积等浓度混合后,两者恰好完全反应生成CH3COONa;
B、CH3COOH是弱酸,不完全电离,pH=3的CH3COOH溶液中的C(H+)=10-3mol/L,只是醋酸中的一部分,即能将pH=11的KOH完全中和,故反应后醋酸过量,所得的是大量过量的CH3COOH和CH3COONa的混合液;
C、NH3?H2O是弱碱,不完全电离,pH=12的NH3?H2O溶液中C(OH-)=10-2mol/L,只是氨水中的一部分,即能将pH=2的HNO3完全中和,即反应后氨水过量,所得的溶液是大量过量的NH3?H2O和NH4Cl的混合液;
D、pH=2的盐酸和pH=11的氢氧化钠按2:9混合后,溶液呈酸性,根据C(H+)混=
来计算.
B、CH3COOH是弱酸,不完全电离,pH=3的CH3COOH溶液中的C(H+)=10-3mol/L,只是醋酸中的一部分,即能将pH=11的KOH完全中和,故反应后醋酸过量,所得的是大量过量的CH3COOH和CH3COONa的混合液;
C、NH3?H2O是弱碱,不完全电离,pH=12的NH3?H2O溶液中C(OH-)=10-2mol/L,只是氨水中的一部分,即能将pH=2的HNO3完全中和,即反应后氨水过量,所得的溶液是大量过量的NH3?H2O和NH4Cl的混合液;
D、pH=2的盐酸和pH=11的氢氧化钠按2:9混合后,溶液呈酸性,根据C(H+)混=
| n(H+)-n(OH-) |
| V酸+V碱 |
解答:
解:A、NaOH是强碱,CH3COOH是弱酸,等体积等浓度混合后,两者恰好完全反应生成CH3COONa,而CH3COONa是强碱弱酸盐,水解显碱性,故应有c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故A错误;
B、CH3COOH是弱酸,不完全电离,pH=3的CH3COOH溶液中的C(H+)=10-3mol/L,而这只是醋酸中的一部分,即能将pH=11的KOH完全中和,故反应后醋酸过量,所得的是大量过量的CH3COOH和CH3COONa的混合液,由于电离大于水解,故溶液显酸性,故离子浓度为c(CH3COO-)>c(K+)>c(H+)>c(OH-),故B错误;
C、NH3?H2O是弱碱,不完全电离,pH=12的NH3?H2O溶液中C(OH-)=10-2mol/L,而这只是氨水中的一部分,即能将pH=2的HNO3完全中和,即反应后氨水大量过量,所得的是大量过量的NH3?H2O和NH4NO3的混合液,溶液中含OH-、NO3-、NH4+、H+,根据溶液的电荷守恒可知有:c(NH4+)+c(H+)=c(OH-)+c(NO3-),故C正确;
D、pH=2的盐酸和pH=11的氢氧化钠按2:9混合后,溶液呈酸性,混合手溶液中C(H+)混=
=
=10-3mol/L,pH=-lg10-3=3,故D错误.
故选C.
B、CH3COOH是弱酸,不完全电离,pH=3的CH3COOH溶液中的C(H+)=10-3mol/L,而这只是醋酸中的一部分,即能将pH=11的KOH完全中和,故反应后醋酸过量,所得的是大量过量的CH3COOH和CH3COONa的混合液,由于电离大于水解,故溶液显酸性,故离子浓度为c(CH3COO-)>c(K+)>c(H+)>c(OH-),故B错误;
C、NH3?H2O是弱碱,不完全电离,pH=12的NH3?H2O溶液中C(OH-)=10-2mol/L,而这只是氨水中的一部分,即能将pH=2的HNO3完全中和,即反应后氨水大量过量,所得的是大量过量的NH3?H2O和NH4NO3的混合液,溶液中含OH-、NO3-、NH4+、H+,根据溶液的电荷守恒可知有:c(NH4+)+c(H+)=c(OH-)+c(NO3-),故C正确;
D、pH=2的盐酸和pH=11的氢氧化钠按2:9混合后,溶液呈酸性,混合手溶液中C(H+)混=
| n(H+)-n(OH-) |
| V酸+V碱 |
| 10-2mol/L×2VL-10-3mol/L×9VL |
| 11VL |
故选C.
点评:本题考查了pH的有关计算、盐类的水解和混合溶液中离子浓度的大小比较,难度不大,分析溶液中离子浓度的大小的关系的时候,应先分析出溶液中的溶质.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 从中药材提取的金丝桃素对人工感染的H5N1亚型禽流感家禽活体具有良好的治愈率.已知金丝桃素的结构简式如图所示.下列有关说法正确的是( )
从中药材提取的金丝桃素对人工感染的H5N1亚型禽流感家禽活体具有良好的治愈率.已知金丝桃素的结构简式如图所示.下列有关说法正确的是( )| A、金丝桃素的分子式为C17H22O3N |
| B、金丝桃素不能与浓硫酸和浓硝酸的混合液反应 |
| C、金丝桃素能在NaOH溶液中加热反应得到两种芳香族化合物 |
| D、金丝桃素在一定条件下能发生加成、酯化、消去和氧化反应 |
下列药品和装置合理,能完成相应实验的是( )
A、 碳酸氢钠受热分解 |
B、 二氧化碳喷泉实验 |
C、 乙二酸与乙二醇酯化反应 |
D、 实验室制氨气 |
在蒸馏实验中,下列操作叙述不正确的是( )
A、在蒸馏烧瓶中盛约
| ||
| B、将温度计水银球与支管口保持水平 | ||
| C、冷水从冷凝管上口入,下口出 | ||
| D、收集蒸馏水时,应弃去开始馏出的部分 |
 25摄氏度时,在20ml 0.1mol/L NaOH溶液中逐滴加入 0.2mol/L的醋酸溶液,曲线如图所示有关离子浓度关系的比较中,正确的是( )
25摄氏度时,在20ml 0.1mol/L NaOH溶液中逐滴加入 0.2mol/L的醋酸溶液,曲线如图所示有关离子浓度关系的比较中,正确的是( )| A、在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| B、在A点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
| C、在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-) |
| D、在C点:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
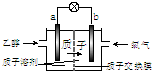 一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在200℃左右时供电(如图所示),比甲醇电池效率高出32倍,且安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O.则下列说法正确的是( )
一种新型的乙醇电池(DEFC)是用磺酸类质子溶剂作电解质,在200℃左右时供电(如图所示),比甲醇电池效率高出32倍,且安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O.则下列说法正确的是( )| A、a极为电池的正极 |
| B、电池正极的电极反应:4H++O2+4e-=2H2O |
| C、电池工作时电子由b极沿导线经灯泡再到a极 |
| D、设每个电子所带电量为q库仑,则1mol乙醇被氧化产生6q×6.02×1023库仑的电量 |
 A、B、C、D都是中学常见的物质,在一定的条件下有如图所示的转化关系(未注明反应条件),请回答下列问题:
A、B、C、D都是中学常见的物质,在一定的条件下有如图所示的转化关系(未注明反应条件),请回答下列问题: