题目内容
4.室温下,下列各组离子在指定溶液中,一定能大量共存的是( )| A. | pH=1的溶液中:Na+、Fe3+、NO3-、I- | |
| B. | 水电离出的c(H+)=1×10-12mol•L-1的溶液中:K+、Al3+、Cl-、SO42- | |
| C. | c(AlO2-)=0.1 mol•L-1的溶液中:Na+、K+、HCO3-、Cl- | |
| D. | 加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、NO3- |
分析 A.pH=1的溶液为酸性溶液,硝酸根离子在酸性条件下能够氧化碘离子,铁离子能够氧化碘离子;
B.水电离出的c(H+)=1×10-12mol•L-1的溶液中存在大量氢离子或氢氧根离子,铝离子与氢氧根离子反应;
C.碳酸氢根离子的酸性大于氢氧化铝,碳酸氢根离子与偏铝酸根离子反应生成氢氧化铝沉淀;
D.四种离子之间不反应,都不与硫氰化钾溶液反应.
解答 解:A.pH=1的溶液为酸性溶液,Fe3+、I-之间发生氧化还原反应,NO3-、I-在酸性条件下也发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.水电离出的c(H+)=1×10-12mol•L-1的溶液中存在大量氢离子或氢氧根离子,Al3+与氢氧根离子反应,在碱性溶液中不能大量共存,故B错误;
C.HCO3-、AlO2-之间反应生成氢氧化铝沉淀和碳酸根离子,在溶液中不能大量共存,故C错误;
D.K+、NH4+、Cl-、NO3-之间不发生反应,都不与KSCN反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
14.下列关于有机物说法正确的是( )
| A. | 乙烷、乙醇和乙酸都可以与钠反应生成氢气 | |
| B. | 石油分馏可获得甲烷、乙烯、苯等 | |
| C. | 苯和乙烯都可以使溴的四氯化碳溶液褪色 | |
| D. |  已知上海世博会永久性标志建筑之-上海世博轴(如图)的上层巨型膜结构ETFE由单体乙烯和四氟乙烯加聚而成:其结构简式为: 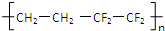 |
15.下列说法不正确的是( )
| A. | 用焰色反应可鉴别NaCl和KCl | |
| B. | 氢氟酸可用于刻蚀玻璃,是利用SiO2酸性氧化物的性质 | |
| C. | 气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气 | |
| D. | 在食品包装袋中放入硅胶防止食品变质,是利用硅胶的吸水性 |
12.NA表示阿伏伽德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24L | |
| B. | 0.1mol/L的NaHSO4溶液中含有阳离子的物质的量为0.2mol | |
| C. | 7.8gNa2S和7.8gNa2O2中含有的阴离子 数目均为0.1NA | |
| D. | 1.8g18O2分子与1.8g18O3分子中含有的中子数不相同 |
19.30mL 0.2mol/L KCl溶液与20mL 0.1mol/L AlCl3溶液中Cl-物质的量浓度之比是( )
| A. | 1:1 | B. | 2:3 | C. | 2:1 | D. | 3:1 |
9.下列叙述中说明某化学平衡一定发生移动的是( )
| A. | 混合体系中气体密度发生变化 | B. | 正、逆反应速率改变 | ||
| C. | 混合物中各组分的浓度改变 | D. | 反应物的转化率改变 |
13.下列关于Na2CO3溶液的说法,正确的是( )
| A. | 相同温度下,Na2C03溶液中水的电离程度比纯水的电离程度小 | |
| B. | 相同温度下,Na2C03溶液中滴加酚酞呈红色,NaHC03溶液中滴加酚酞颜色更深 | |
| C. | VLamoL/L的Na2C03溶液中,若C032-的数目为NA;则Na+的数目大于2NA | |
| D. | CaC03在饱和Na2C03溶液中的KSP比在纯水中的KSP小 |
14.I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?═?I3-(aq).测得不同温度下该反应的平衡常数如下表:
下列说法正确的是( )
| t/℃ | 5 | 15 | 25 | 35 | 50 |
| K | 1 000 | 850 | 690 | 625 | 400 |
| A. | 反应I2(aq)+I-(aq)?═?I3-(aq)的△H>0 | |
| B. | 利用该反应可以除去硫粉中少量的碘单质 | |
| C. | 在上述平衡体系中加入苯,平衡不移动 | |
| D. | 25℃时,向溶液中加入少量KI固体,平衡常数K小于690 |