题目内容
19.30mL 0.2mol/L KCl溶液与20mL 0.1mol/L AlCl3溶液中Cl-物质的量浓度之比是( )| A. | 1:1 | B. | 2:3 | C. | 2:1 | D. | 3:1 |
分析 氯离子的物质的量浓度与溶液体积大小无关,与溶质浓度、溶质的化学式组成有关,如:30mL 0.2mol/L KCl溶液中氯离子的物质的量浓度为:0.1mo/L×1=0.2mol/L,20mL 0.1mol/L AlCl3溶液中Cl-物质的量浓度为:0.1mol/L×3=0.3mol/L,据此计算出两溶液中氯离子的物质的量浓度.
解答 解:30mL 0.2mol/L KCl溶液中氯离子的物质的量浓度为:0.1mo/L×1=0.2mol/L,
20mL 0.1mol/L AlCl3溶液中Cl-物质的量浓度为:0.1mol/L×3=0.3mol/L,
两溶液中氯离子的物质的量浓度之比为:0.2mol/L:0.3mol/L=2:3,
故选B.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意离子的浓度与溶液体积大小无关,为易错点,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
9.在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),已知该反应的平衡常数与温度的关系如下表:
下列说法不正确的是( )
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
| A. | 上述生成Ni(CO)4的反应为放热反应 | |
| B. | 在80℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol•L-1,则此时v正>v逆 | |
| C. | 25℃时反应Ni(CO)4(g) Ni(s)+4CO(g)的平衡常数为2×10-5 | |
| D. | 80℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol•L-1 |
10.下表是某矿泉水的部分标签说明

则该饮用水中还可能较大量存在的离子是( )

则该饮用水中还可能较大量存在的离子是( )
| A. | OH- | B. | Ag+ | C. | Na+ | D. | Ba2+ |
7.按电子排布,可以把周期表中的元素划分成几个区( )
| A. | 4个 | B. | 5个 | C. | 6个 | D. | 7个 |
14.我国古代四大发明之一的黑火药爆炸时的反应为:S+2KNO3+3C═K2S+N2↑+3CO2↑,下列关于该反应的说法正确的是( )
| A. | 氧化剂只有KNO3 | B. | C发生还原反应 | C. | KNO3被氧化 | D. | S得到了电子 |
4.室温下,下列各组离子在指定溶液中,一定能大量共存的是( )
| A. | pH=1的溶液中:Na+、Fe3+、NO3-、I- | |
| B. | 水电离出的c(H+)=1×10-12mol•L-1的溶液中:K+、Al3+、Cl-、SO42- | |
| C. | c(AlO2-)=0.1 mol•L-1的溶液中:Na+、K+、HCO3-、Cl- | |
| D. | 加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、NO3- |
11.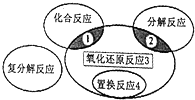 氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( )
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( )
 氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( )
氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是( )| A. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | B. | 2Na2HCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | Zn+H2SO4═ZnSO4+H2↑ |
8.下列说法正确的是( )
| A. | 热化学方程式中,化学式前面的化学计量数只能表示物质的量 | |
| B. | 1 moL H2生成1 mol H20时放出的热量就是氢气的燃烧热的值 | |
| C. | 用1mol/L的硫酸和适量的稀的Ba(OH)2溶液反应可以测量中和热的值 | |
| D. | 条件相同,用16g固体硫或32 g固体硫分别在02中充分燃烧,测定的硫的燃烧热不同 |
9.下列指定溶液中一定能大量共存的离子组是( )
| A. | 含有大量AlO2-的溶液中:Na+、K+、HCO3-、NO3- | |
| B. | 中性溶液中:K+、Cl-、SO42-、Al3+ | |
| C. | 加Al粉产生H2溶液中:SO42-、K+、Cu2+、Cl- | |
| D. | pH=1的溶液中:NH4+、Na+、Fe3+、SO42- |