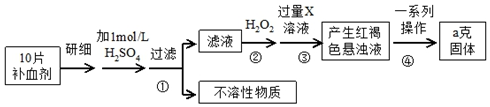
题目内容
11.某学生需要用烧碱固体配制1mol•L-1的NaOH溶液450mL.请回答下列问题:(1)计算:需要称取NaOH固体20.0g.
(2)配制时,必须使用的仪器有托盘天平(带砝码)、药匙、烧杯、玻璃棒、量简,还缺少的仪器是500ml 容量瓶、胶头滴管.(填仪器名称)
(3)在使用容量瓶前必须进行的一步操作是查漏.
(4)实验两次用到玻璃棒,其作用分别是:先用于搅拌、后用于引流.
(5)若出现如下情况,其中将引起所配溶液浓度偏高的是BDF(不定项)
A容量瓶实验前用蒸馏水洗干净,但未烘干
B天平砝码生锈
C配制过程中遗漏了洗涤步骤
D未冷却到室温就注入容量瓶
E加蒸馏水时不慎超过了刻度线
F定容观察液面时俯视
(6)若实验过程中出现(5)中D这种情况你将如何处理?用胶头滴管逐滴滴加蒸馏水到凹液面最低处有刻度线相切.
分析 (1)依据配制溶液体积选择容量瓶规格,依据m=CVM计算溶质的质量;
(2)依据配制一定物质的量一般步骤选择需要仪器;
(3)容量瓶带有活塞,为防止漏水,使用前应检查是否漏水;
(4)溶解过程需要用玻璃棒搅拌;移液过程需要用玻璃棒引流;
(5)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(6)凡是不当操作导致实验失败且无法补救的应重新配制,能够补救的可以按照正确操作补救.
解答 解:(1)配制1mol•L-1的NaOH溶液450mL,应选择500mL容量瓶,实际配制500mL容量瓶,需要溶质的质量m=1mol/L×0.5L×40g/mol=20.0g;
故答案为:20.0;
(2)配制溶液的操作步骤:首先计算出需要的溶质的质量,然后天平称量,后放入烧杯中溶解,同时用玻璃棒搅拌,待溶液冷却至室温后,用玻璃杯引流移液至500ml容量瓶,然后洗涤烧杯和玻璃棒2至3次,将洗涤液也注入容量瓶,然后向容量瓶中注水,至液面离刻度线1至2CM时,改用胶头滴管逐滴加入,至凹液面与刻度线相切,然后摇匀、装瓶.在此过程中用到的仪器有:天平、量筒、烧杯、玻璃棒、500ml容量瓶、胶头滴管,还缺少的仪器:500ml 容量瓶、胶头滴管;
故答案为:500ml 容量瓶;胶头滴管;
(3)容量瓶带有活塞,为防止漏水,使用前应检查是否漏水;
故答案为:查漏;
(4)溶解过程需要用玻璃棒搅拌;移液过程需要用玻璃棒引流;
故答案为:搅拌;引流;
(5)A.容量瓶实验前用蒸馏水洗干净,但未烘干,对溶质的物质的量和溶液的体积都不产生影响,溶液浓度不变,故A不选;
B.天平砝码生锈,导致称取的溶质的质量偏大,溶液浓度偏高,故B选;
C配制过程中遗漏了洗涤步骤,导致溶质的物质的量偏小,溶液浓度偏低,故C不选;
D未冷却到室温就注入容量瓶,冷却后溶液体积偏小,溶液浓度偏高,故D选;
E加蒸馏水时不慎超过了刻度线,导致溶液体积偏大,溶液浓度偏低,故E不选;
F定容观察液面时俯视,导致溶液体积偏小,溶液浓度偏高,故F选;
故选:BDF;
(6)未冷却到室温就注入容量瓶,冷却后液面下降,实验失败,但是可以补救:用胶头滴管逐滴滴加蒸馏水到凹液面最低处有刻度线相切;
故答案为:用胶头滴管逐滴滴加蒸馏水到凹液面最低处有刻度线相切.
点评 本题考查了物质的量浓度的有关计算及配制一定物质的量浓度的溶液误差分析,难度不大,明配制原理及操作步骤是解题关键,要注意配制一定物质的量浓度溶液的误差分析,根据验操作对c=$\frac{n}{V}$产生的影响判断,分析变化的物理量,从而确定浓度的变化.

 阅读快车系列答案
阅读快车系列答案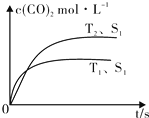 2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.
①写出该反应的平衡常数表达式K=$\frac{[CH{\;}_{3}OCH{\;}_{3}]•[H{\;}_{2}O]{\;}^{3}}{[CO{\;}_{2}]{\;}^{2}•[H{\;}_{2}]{\;}^{6}}$.
②判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是BD.
A.容器中密度不变
B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
C.v(CO2):v(H2)=1:3
D.容器内压强保持不变
(2)汽车尾气净化的主要原理为:2NO(g)+2CO (g) $\stackrel{催化剂}{?}$2CO2 (g)+N2 (g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.据此判断:
①该反应的△H<0(选填“>”、“<”).
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线.
(3)已知:CO(g)+2H2(g)?CH3OH(g)△H=-a kJ•mol-1.
①经测定不同温度下该反应的平衡常数如下:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
| A. | 500 mL溶液中的阴、阳离子总数为0.3NA | |
| B. | 500 mL溶液中NO3-离子浓度为0.2mol/L | |
| C. | 500 mL溶液中Ba2+离子浓度为0.2mol/L | |
| D. | 500 mL溶液中NO3-离子总数为0.2NA |