题目内容
20.在一定条件下,反应2HI(g)?H2(g)+I2(g)△H>0达到平衡时,要使混合气体的颜色变浅,可采取的措施是 ( )①增大氢气的浓度 ②升高温度 ③降低温度 ④增大压强⑤增大HI的浓度 ⑥扩大体积 ⑦加催化剂.
| A. | ①③⑥ | B. | ③⑤⑥ | C. | ①③⑤ | D. | ②④⑤ |
分析 要使混合气体的颜色变浅,即减小碘的浓度,平衡逆向移动,从影响平衡移动的因素角度考虑.
解答 解:①增大氢气的浓度,平衡逆向移动,混合气体的颜色变浅,故正确;
②升高温度,平衡正向移动,混合气体的颜色加深,故错误;
③降低温度,平衡逆向移动,混合气体的颜色变浅,故正确;
④增大压强,相当于缩小体积,各种气体的浓度都增大,混合气体的颜色加深,故错误;
⑤增大HI浓度,平衡正向移动,碘浓度增大,混合气体的颜色加深,故错误;
⑥减小压强,各气体浓度减小,混合气体的颜色变浅,故正确;
⑦加催化剂,平衡不移动,混合气体的颜色不变,故错误;
故选A.
点评 本题考查了影响平衡移动的因素,注意影响平衡移动的因素有温度、浓度、压强三种,题目难度不大.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
11.参照反应Br+H2═HBr+H的能量对反应历程的示意图,下列叙述中正确的是( )
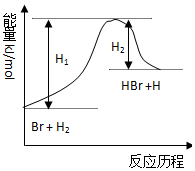

| A. | 正反应为放热反应 | |
| B. | 加入催化剂,该化学反应的反应热不改变 | |
| C. | 逆反应为吸热反应 | |
| D. | 加入催化剂可增大正反应速率,降低逆反应速率 |
15.某苯的同系物分子式为C10H14,其中能被酸性KMnO4溶液氧化成苯甲酸的同分异构体有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
9.在无色溶液中,下列离子可以共存的是( )
| A. | Ca2+Mg2+ CO32-Cl- | B. | Fe3+Cl- Na+H+ | ||
| C. | H+ Ag+ NO3- NH4+ | D. | CO32-H+Na+OH- |
6.下列离子方程式书写正确的是( )
| A. | H2SO3溶液和NaHCO3溶液反应:H2SO3+2HCO3-=SO32-+2CO2↑+2H2O | |
| B. | 控制pH为9~10,用NaClO溶液将含NaCN的废水中的CN-氧化为两种无污染的气体:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O | |
| C. | 已知硫酸铅难溶于水,也难溶于硝酸,却可溶于醋酸铵溶液中,形成无色溶液.当Pb(CH3COO)2溶液中通入H2S气体时有黑色沉淀生成:Pb2++H2S=PbS↓+2H+ | |
| D. | CuSO4溶液与过量浓氨水反应:Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O |
7.下列反应的离子方程式能用H++OH-═H2O来表示的是( )
| A. | 氢氧化钾溶液和稀硝酸反应 | B. | 氢氧化镁和稀稀盐酸反应 | ||
| C. | Ba(OH)2溶液滴入稀硫酸中 | D. | 二氧化碳通入澄清石灰水中 |