题目内容
8.(1)9.8gH2SO4的物质的量是0.1mol;2.0molH2O的质量是36g.(2)含Al3+5.4g的硫酸铝的物质的量为0.1mol,其中含SO42-0.3NA个.
(3)某二价金属1.6g在氧气中完全燃烧生成2g氧化物,则该金属的相对原子量64.
(4)6.02×1023个CO2与22molH2质量相等,与64gSO2含有的氧原子数相等.
分析 (1)根据n=$\frac{m}{M}$计算出硫酸的物质的量,根据m=nM计算出水的质量;
(2)根据n=$\frac{m}{M}$计算出铝离子的物质的量,然后结合硫酸铝的化学式计算出硫酸铝、硫酸根离子的物质的量,最高价N=nNA计算出含有硫酸根离子的数目;
(3)该氧化物的化学式为RO,根据质量不会计算出消耗O原子的物质的量,然后可得出该金属的物质的量,最高价M=$\frac{m}{n}$计算出其摩尔质量,从而可知其相对原子量;
(4)根据n=$\frac{N}{{N}_{A}}$计算出二氧化碳的物质的量,最高价m=nM计算出其质量,最高价n=$\frac{m}{M}$计算出需要氢气的质量;根据二氧化碳的物质的量计算出含有O的物质的量,然后计算出需要二氧化硫的物质的量,再根据m=nM计算出二氧化硫的质量.
解答 解:(1)9.8gH2SO4的物质的量为:$\frac{9.8g}{98g/mol}$=0.1mol;2.0molH2O的质量是:18g/mol×2.0mol=36g,
故答案为:0.1mol;36g;
(2)5.gAl3+5的物质的量为:$\frac{5.4g}{27g/mol}$=0.2mol,该硫酸铝的物质的量为:0.2mol×$\frac{1}{2}$=0.1mol,其中含SO42- 的物质的量为:0.1mol×3=0.3mol,含有硫酸根离子的数目为0.3NA,
故答案为:0.1mol;0.3NA;
(3)某二价金属1.6g在氧气中完全燃烧生成2g氧化物,设该氧化物的化学式为RO,反应消耗O原子的质量为:2g-1.6g=0.4g,消耗O的物质的量为:$\frac{0.4g}{16g/mol}$=$\frac{1}{40}$mol,该金属原子的摩尔质量为:$\frac{1.6g}{\frac{1}{40}mol}$64g/mol,其相对原子量为64,
故答案为:64;
(4)6.02×1023个CO2的物质的量为:$\frac{6.02×1{0}^{23}}{6.02×1{0}^{23}mo{l}^{-1}}$=1mol,其质量为:44g/mol×1mol=44g,质量相等时需要氢气的物质的量为:$\frac{44g}{2g/mol}$=22mol;1mol二氧化碳分子中含有2molO原子,含有氧原子相同时需要二氧化碳的物质的量为1mol,质量为:64g/mol×1mol=64g,
故答案为:22;64.
点评 本题考查了物质的量的计算,题目难度中等,明确物质的量与其它物理量之间的关系即可解答,试题培养了学生的化学计算能力.

 阅读快车系列答案
阅读快车系列答案| A. | CH4 | B. | NH3 | C. | HCl | D. | H2O |
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 甲烷(乙烯) | 溴水 | 洗气 |
| C | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 蒸馏 |
| D | 溴乙烷(乙醇) | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 0.9g水中含有的电子数为NA | |
| B. | 常温常压下,0.2 NA个NH3分子的质量为3.4g | |
| C. | 14.0g由C2H4和C3H6组成的混合气体原子总数为3NA | |
| D. | 1 mol Na变为Na+时失去的电子数目为NA |
| A. | 升高温度,K值增大 | B. | K值越大,反应物转化率越大 | ||
| C. | 加入催化剂不改变平衡常数K | D. | 平衡向右移动K值不一定改变 |
 已知某市售“84消毒液”瓶体部分标签如下图所示,该“84 消毒液”通常稀释100 倍(体积之比)后使用. 请回答下列问题:
已知某市售“84消毒液”瓶体部分标签如下图所示,该“84 消毒液”通常稀释100 倍(体积之比)后使用. 请回答下列问题:
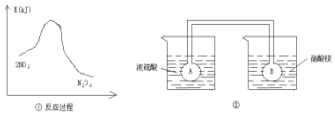 利用图①中的信息,按图②装置链接的A、B瓶中已充有NO2气体.B瓶中的气体颜色比A瓶中的浅(填“深”或“浅”),其原因是2NO?N2O4△H<0,A瓶加热,平衡左移颜色加深,B瓶降低温度,平衡右移颜色变浅.
利用图①中的信息,按图②装置链接的A、B瓶中已充有NO2气体.B瓶中的气体颜色比A瓶中的浅(填“深”或“浅”),其原因是2NO?N2O4△H<0,A瓶加热,平衡左移颜色加深,B瓶降低温度,平衡右移颜色变浅.