题目内容
14.常温下,将20.0g 14.0%的NaCl溶液,跟30.0g 24.0%的NaCl溶液混合,得到密度为1.15g•cm-3的混合溶液.计算:(1)该混合溶液中溶质的质量分数;
(2)该溶液中溶质的物质的量浓度;
(3)在1 000g水中需溶入多少摩尔NaCl,才能使其浓度恰好与上述混合溶液的浓度相等?
分析 (1)根据质量分数的表达式w=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%计算;
(2)先根据溶液的质量与密度的关系计算溶液的体积,再根据溶液的质量与质量分数求出溶质的质量,继而求出溶质的物质的量,根据物质的量浓度公式求出溶液的物质的量浓度;
(3)设需要加入氯化钠的物质的量为x,然后根据w=$\frac{{m}_{溶质}}{{m}_{溶液}}$×100%计算.
解答 解:(1)20.0g质量分数为14.0%的NaCl溶液中溶质的质量为:20.0g×14.0%=2.8g;30.0g质量分数为24.0%的NaCl溶液溶质的质量为:30.0g×24.0%=7.2g,溶液混合前后溶质、溶液的质量都不变,所以混合液的质量分数为:$\frac{2.8g+7.2g}{20.0g+30.0g}$×100%=20%,
答:该混合溶液中溶质的质量分数为20%;
(2)混合溶液的密度为1.15g/cm3,NaCl的质量分数为20%,则混合后NaCl的物质的量浓度c=$\frac{1000×1.15×20%}{58.5}$mol/L=3.93mol/L,
答:该溶液中溶质的物质的量浓度为3.93mol/L.
(3)设应溶解的NaCl的物质的量为x,
则:$\frac{58.5x}{1000+58.5x}$×100%=20%,
解得:x=4.27 mol
答:需要加入的氯化钠的物质的量为4.27mol.
点评 本题考查了溶质质量分数的计算,题目难度中等,明确质量分数的表达式为解答关键,注意熟练掌握物质的量与摩尔质量、物质的量浓度之间的关系,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
5.下列关于金属腐蚀的说法正确的是( )
| A. | 金属在潮湿的空气中腐蚀的实质是:M+nH2O═M(OH)n+$\frac{n}{2}$H2↑ | |
| B. | 金属的化学腐蚀的实质是:M-ne-═Mn+,电子直接转移给还原剂 | |
| C. | 金属的化学腐蚀必须在酸性条件下进行 | |
| D. | 在潮湿的中性环境中金属的电化学腐蚀主要是吸氧腐蚀 |
19.下列溶液中各离子的浓度关系正确的是( )
| A. | 0.1 mol•L-1CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)═0.1 mol•L-1 | |
| B. | 25℃时,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(C6H5ONa)>pH(NaHCO3)>pH(CH3COONa) | |
| C. | 25℃时,pH=9.4,浓度均为0.1 mol•L-1的HCN与NaCN的混合溶液中:c(Na+)>c(HCN)>c(CN-)>c(OH-) | |
| D. | 将足量AgCl分别放入:①5m水,②10mL0.2mol/LMgC12,③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③ |
6.将c mol•L-1的AlCl3溶液V1 mL加水稀释至V2 mL,稀释后溶液中Cl-物质的量浓度为( )
| A. | $\frac{{V}_{1}}{{V}_{2}}$c mol•L-1 | B. | $\frac{{V}_{1}}{{V}_{2}}$c mol•L-1 | ||
| C. | $\frac{{3V}_{2}}{{V}_{1}}$c mol•L-1 | D. | $\frac{3{V}_{1}}{{V}_{2}}$c mol•L-1 |
3. 有X、Z、W三种含14个电子的粒子,其结构特点如下:
有X、Z、W三种含14个电子的粒子,其结构特点如下:
(1)X的氧化物晶体中含有化学键类型是共价键.
(2)Z与钙离子组成的化台物的电子式为Ca2+[C??C]2-.
(3)组成W的元素的简单氢化物极易溶于水的主要原因是NH3与H2O间能形成氢键,NH3与H2O都是极性分子且相互间能反应生成一水合氨,该氢化物与
空气可以构成一种燃料电池,产物为无毒物质,电解质溶液是KOH溶液,其负极的电极
反应式为2NH3-6e-+6OH-═N2+6H2O.在常温下,用该电池电解1.5L 1mol/LNaCl溶液,当消耗标准状
况下1.12LW的简单氯化物时,NaCI溶液的pH=13(假设电解过程中溶液
的体积不变).
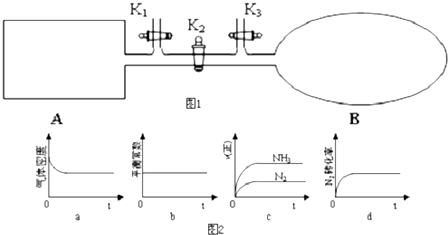
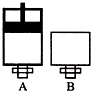
(4)M原子核外比X原予多2个电子.可逆反应2MO2(气)+O2(气)?-2MO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B容器可保持恒容(如图所示),若在A.、B中分别充入ImolO2和2mol MO2,使气体体积V(A)=V(B),在相同温度下反应.则:达平衡所需时间:t(A)<
t (B)(填“>”、“<”、“=”,或“无法确定”,下同).平衡时MO!的转化率:a(A)>a(B).
(5)欲比较X和M两元素的非金属性相对强弱,可采取的措施有c、d(填序号).
a.比较这两种元素的气态氢化物的沸点
b.比较这两种元素的单质在常温下的状态
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素的单质与氢气化合的难易.
 有X、Z、W三种含14个电子的粒子,其结构特点如下:
有X、Z、W三种含14个电子的粒子,其结构特点如下:| 粒子代码 | X | Z | W |
| 原子核数目 | 单核 | 同种元素构成的两核 | 同种元素构成的两核 |
| 粒子的电性 | 电中性 | 两个单位负电荷 | 电中性 |
(2)Z与钙离子组成的化台物的电子式为Ca2+[C??C]2-.
(3)组成W的元素的简单氢化物极易溶于水的主要原因是NH3与H2O间能形成氢键,NH3与H2O都是极性分子且相互间能反应生成一水合氨,该氢化物与
空气可以构成一种燃料电池,产物为无毒物质,电解质溶液是KOH溶液,其负极的电极
反应式为2NH3-6e-+6OH-═N2+6H2O.在常温下,用该电池电解1.5L 1mol/LNaCl溶液,当消耗标准状
况下1.12LW的简单氯化物时,NaCI溶液的pH=13(假设电解过程中溶液
的体积不变).
(4)M原子核外比X原予多2个电子.可逆反应2MO2(气)+O2(气)?-2MO3(气)在两个密闭容器中进行,A容器中有一个可上下移动的活塞,B容器可保持恒容(如图所示),若在A.、B中分别充入ImolO2和2mol MO2,使气体体积V(A)=V(B),在相同温度下反应.则:达平衡所需时间:t(A)<
t (B)(填“>”、“<”、“=”,或“无法确定”,下同).平衡时MO!的转化率:a(A)>a(B).
(5)欲比较X和M两元素的非金属性相对强弱,可采取的措施有c、d(填序号).
a.比较这两种元素的气态氢化物的沸点
b.比较这两种元素的单质在常温下的状态
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素的单质与氢气化合的难易.
4.莫尔盐[(NH4)2Fe(SO4)2•6H2O]常作氧化还原滴定法的基准物质,下列有关该盐溶液的比较,不正确的是( )
| A. | c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | B. | c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) | ||
| C. | 2c(SO42-)+c(OH-)=c(NH4+)+2c(Fe2+)+c(H+) | D. | c(NH4+)+c(NH3•H2O)=2c(Fe2+)+2c[Fe(OH)2] |
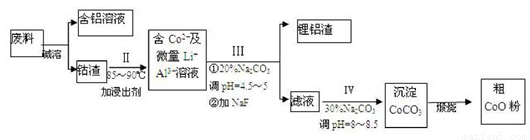
 钴以Co2O3 ·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下:
钴以Co2O3 ·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下: