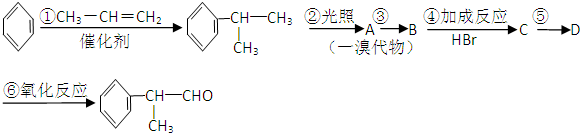
题目内容
以下是依据一定的分类标准,对某些物质与水的反应情况进行分类的分类图.请根据你所学的知识按要求填空:
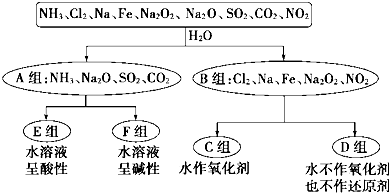
(1)上述第一级分类标准(分成A、B组的依据)是:
(2)D组物质包括 (填化学式).
(3)C组物质中某一物质在常温时能与冷水反应,其化学方程式为 .
(4)D组中某一物质与E组中某一物质在水中反应生成两种强酸,写出该反应的离子方程式: .

(1)上述第一级分类标准(分成A、B组的依据)是:
(2)D组物质包括
(3)C组物质中某一物质在常温时能与冷水反应,其化学方程式为
(4)D组中某一物质与E组中某一物质在水中反应生成两种强酸,写出该反应的离子方程式:
考点:酸、碱、盐、氧化物的概念及其相互联系
专题:物质的分类专题
分析:(1)依据图表变化和物质分类分析变化判断;
(2)水在氧化还原反应中既不是氧化剂也不是还原剂的为氯气、二氧化氮、过氧化钠;
(3)水在氧化还原反应中作氧化剂,则该物质作还原剂,且在常温下能与水反应只有钠;
(4)根据SO2、Cl2与水能反应生成硫酸和盐酸.
(2)水在氧化还原反应中既不是氧化剂也不是还原剂的为氯气、二氧化氮、过氧化钠;
(3)水在氧化还原反应中作氧化剂,则该物质作还原剂,且在常温下能与水反应只有钠;
(4)根据SO2、Cl2与水能反应生成硫酸和盐酸.
解答:
解:(1)溶于水分成AB两组的依据,分析反应过程可知,NH3、Na2O、SO2、CO2溶于水发生化合反应生成对应酸或碱,NH3+H2O?NH3?H2O;Na2O+H2O═2NaOH;SO2+H2O?H2SO3;CO2+H2O?H2CO3;是非氧化还原反应;
Cl2、Na、Fe、Na2O2、NO2,溶于水反应Cl2+H2O?HCl+HClO、2Na+2H2O═2NaOH+H2↑、3Fe+4H2O
Fe3O4+4H2、2Na2O2+2H2O═4NaOH+O2↑、3NO2+H2O═2HNO3+NO发生的是氧化还原反应,所以依据是否发生氧化还原反应,
故答案为:是否发生氧化还原反应;
(2)Cl2、Na、Fe、Na2O2、NO2,溶于水反应发生的是氧化还原反应,
Cl2+H2O?HCl+HClO 氯气自身氧化还原;
2Na+2H2O=2NaOH+H2↑ 钠做还原剂被水氧化;
3Fe+4H2O
Fe3O4+4H2 铁做还原剂被水氧化;
2Na2O2+2H2O=4NaOH+O2↑ Na2O2自身氧化还原;
3NO2+H2O=2HNO3+NO 二氧化氮自身氧化还原反应;
所以水既不是氧化剂也不是还原剂D组物质包括Cl2、Na2O2、NO2,
故答案为:Cl2、Na2O2、NO2;
(3)钠在常温时能与冷水反应,反应生成过氧化钠和氢气,反应为2Na+2H2O═2NaOH+H2↑,
故答案为:2Na+2H2O═2NaOH+H2↑;
(4)E组水溶性呈酸性的是二氧化硫和二氧化碳,D组包括Cl2、Na2O2、NO2,SO2、Cl2与水能反应生成硫酸和盐酸,所以D组中某一物质与E组中某一物质在水中反应生成两种强酸,为二氧化硫和氯气的反应,离子反应方程式为:Cl2+SO2+2H2O═2Cl-+SO42-+4H+,
故答案为:Cl2+SO2+2H2O═2Cl-+SO42-+4H+.
Cl2、Na、Fe、Na2O2、NO2,溶于水反应Cl2+H2O?HCl+HClO、2Na+2H2O═2NaOH+H2↑、3Fe+4H2O
| ||
故答案为:是否发生氧化还原反应;
(2)Cl2、Na、Fe、Na2O2、NO2,溶于水反应发生的是氧化还原反应,
Cl2+H2O?HCl+HClO 氯气自身氧化还原;
2Na+2H2O=2NaOH+H2↑ 钠做还原剂被水氧化;
3Fe+4H2O
| ||
2Na2O2+2H2O=4NaOH+O2↑ Na2O2自身氧化还原;
3NO2+H2O=2HNO3+NO 二氧化氮自身氧化还原反应;
所以水既不是氧化剂也不是还原剂D组物质包括Cl2、Na2O2、NO2,
故答案为:Cl2、Na2O2、NO2;
(3)钠在常温时能与冷水反应,反应生成过氧化钠和氢气,反应为2Na+2H2O═2NaOH+H2↑,
故答案为:2Na+2H2O═2NaOH+H2↑;
(4)E组水溶性呈酸性的是二氧化硫和二氧化碳,D组包括Cl2、Na2O2、NO2,SO2、Cl2与水能反应生成硫酸和盐酸,所以D组中某一物质与E组中某一物质在水中反应生成两种强酸,为二氧化硫和氯气的反应,离子反应方程式为:Cl2+SO2+2H2O═2Cl-+SO42-+4H+,
故答案为:Cl2+SO2+2H2O═2Cl-+SO42-+4H+.
点评:本题考查了物质性质的应用,物质分类依据分析,溶于水的反应特征判断是解题关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
已知热化学方程式:则氢气的燃烧热为( )
①H2(g)+
O2(g)═H2O(g)△H=-241.8kJ?mol-1
②2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
③H2(g)+
O2(g)═H2O(l)△H=-285.8kJ?mol-1
④2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1?
①H2(g)+
| 1 |
| 2 |
②2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
③H2(g)+
| 1 |
| 2 |
④2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1?
| A、-241.8 kJ?mol-1 |
| B、-483.6 kJ?mol-1 |
| C、-285.8 kJ?mol-1 |
| D、-571.6 kJ?mol-1 |
有BaCl2和KCl的混合溶液100mL,将它分成两等份.一份滴加0.1mol?L-1稀硫酸25mL,使Ba2+完全沉淀;另一份滴加0.2mol?L-1 AgNO3溶液75mL,使Cl-完全沉淀.据此得知原混合溶液中的K+的物质的量浓度为( )
| A、0.1 mol?L-1 |
| B、0.125mol?L-1 |
| C、0.2 mol?L-1. |
| D、0.25mol?L-1 |
下列反应中属于氧化还原反应,且水既不作氧化剂又不作还原剂的是( )
| A、SO3+H2O=H2SO4 | ||||
| B、Cl2+H2O=HCl+HClO | ||||
| C、2F2+2H2O=4HF+O2 | ||||
D、C+H2O
|
如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( )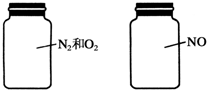

| A、所含质子数相等 |
| B、气体密度相等 |
| C、所含原子数相等 |
| D、摩尔质量相等 |
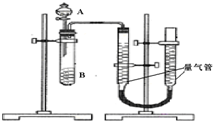 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.该反应的离子方程式为2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.该反应的离子方程式为2MnO4-+5H2C2O4+6H+═2Mn2++10CO2+8H2O.设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
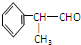 的物质,该物质是一种香料.
的物质,该物质是一种香料.