题目内容
有BaCl2和KCl的混合溶液100mL,将它分成两等份.一份滴加0.1mol?L-1稀硫酸25mL,使Ba2+完全沉淀;另一份滴加0.2mol?L-1 AgNO3溶液75mL,使Cl-完全沉淀.据此得知原混合溶液中的K+的物质的量浓度为( )
| A、0.1 mol?L-1 |
| B、0.125mol?L-1 |
| C、0.2 mol?L-1. |
| D、0.25mol?L-1 |
考点:物质的量浓度的相关计算
专题:计算题
分析:根据反应Ba2++SO42-═BaSO4↓、Ag++Cl-═AgCl↓计算离子的物质的量,由混合溶液分成2等份,则确定原溶液中钡离子和氯离子的浓度,再利用溶液不显电性来计算原混合溶液中钾离子物质的量浓度.
解答:
解:根据Ba2++SO42-═BaSO4↓可知:n(Ba2+)=n(SO42-)=0.1mol/L×0.025L=0.0025 mol,
根据反应Ag++Cl-═AgCl↓,则:n(Cl-)=n(AgNO3)=0.2mol/L×0.075L=0.015mol,
每份溶液中含有:n(Ba2+)=0.0025molmol,n(Cl-)=0.015mol,
由混合溶液分成2等份,则原溶液中钡离子的浓度为:
=0.05mol/L,
氯离子的浓度为:
=0.3mol/L,
根据溶液不显电性,设原混合溶液中钾离子物质的量浓度为x,
则:0.05mol/L×2+x×1=0.3mol/L×1,
解得:x=0.2mol/L,所以C正确,
故选C.
根据反应Ag++Cl-═AgCl↓,则:n(Cl-)=n(AgNO3)=0.2mol/L×0.075L=0.015mol,
每份溶液中含有:n(Ba2+)=0.0025molmol,n(Cl-)=0.015mol,
由混合溶液分成2等份,则原溶液中钡离子的浓度为:
| 0.0025mol×2 |
| 0.1L |
氯离子的浓度为:
| 0.015mol×2 |
| 0.1L |
根据溶液不显电性,设原混合溶液中钾离子物质的量浓度为x,
则:0.05mol/L×2+x×1=0.3mol/L×1,
解得:x=0.2mol/L,所以C正确,
故选C.
点评:本题考查了有关物质的量浓度的计算,题目难度不大,试题侧重基础知识的考查,注意掌握物质的量浓度的概念及表达式,明确电荷守恒在化学计算中的应用,试题有利于培养学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
下列物质中,不属于合成材料的是( )
| A、塑料 | B、棉花 |
| C、合成纤维 | D、合成橡胶 |
某学生做完实验后,采用以下方法分别清洗仪器,其中应用“相似相溶”规律的是( )
| A、用稀硝酸清洗做过银镜反应的试管 |
| B、用稀盐酸清洗做高锰酸钾分解实验的试管 |
| C、用氢氧化钠溶液清洗盛过硅酸的试管 |
| D、用四氯化碳清洗做过碘升华的烧杯 |
下列各组离子可以在溶液中大量共存的是( )
| A、K+、Mg2+、SO42-、OH- |
| B、Na+、H+、Cl-、HCO3- |
| C、K+、Ag+、NO3-、Cl- |
| D、K+、Cu2+、SO42-、NO3- |
下列说法中,正确的是( )
| A、反应产物的总能量大于反应物的总能量时,△H<0 |
| B、在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
| C、△H<0、△S>0的反应在温度低时不能自发进行 |
| D、一个化学反应的△H仅与反应的起始状态和反应的最终状态有关,与反应途径无关 |
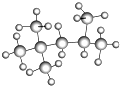 的名称(系统命名法)是
的名称(系统命名法)是