题目内容
已知热化学方程式:则氢气的燃烧热为( )
①H2(g)+
O2(g)═H2O(g)△H=-241.8kJ?mol-1
②2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
③H2(g)+
O2(g)═H2O(l)△H=-285.8kJ?mol-1
④2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1?
①H2(g)+
| 1 |
| 2 |
②2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
③H2(g)+
| 1 |
| 2 |
④2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1?
| A、-241.8 kJ?mol-1 |
| B、-483.6 kJ?mol-1 |
| C、-285.8 kJ?mol-1 |
| D、-571.6 kJ?mol-1 |
考点:用盖斯定律进行有关反应热的计算
专题:
分析:热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比,燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,据此分析解答.
解答:
解:A.H2(g)+
O2(g)═H2O(g)△H=-241.8kJ?mol-1气态水不是稳定氧化物,所以-241.8kJ?mol-1不是氢气的燃烧热,故A错误;
B.2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ?mol-1气态水不是稳定氧化物,且氢气的物质的量为2mol,所以-241.8kJ?mol-1不是氢气的燃烧热,故B错误;
C.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,H2(g)+
O2(g)═H2O(l)△H=-285.8kJ?mol-1液态水是稳定氧化物,且氢气的物质的量为1mol,所以-285.8kJ?mol-1是氢气的燃烧热,故C正确;
D.燃烧热是1mol可燃物,2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1氢气的物质的量为2mol,所以-571.6kJ?mol-1不是氢气的燃烧热,故D错误;
故选C.?
| 1 |
| 2 |
B.2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ?mol-1气态水不是稳定氧化物,且氢气的物质的量为2mol,所以-241.8kJ?mol-1不是氢气的燃烧热,故B错误;
C.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,H2(g)+
| 1 |
| 2 |
D.燃烧热是1mol可燃物,2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ?mol-1氢气的物质的量为2mol,所以-571.6kJ?mol-1不是氢气的燃烧热,故D错误;
故选C.?
点评:本题考查了热化学方程式的含义以及燃烧热的应用,题目难度不大,注意掌握热化学方程式的书写规则.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案
相关题目
下列物质中,不属于合成材料的是( )
| A、塑料 | B、棉花 |
| C、合成纤维 | D、合成橡胶 |
下列相关实验示意图不能达到实验目的是( )
A、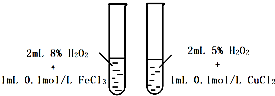 探究不同催化剂对H2O2分解速率影响 |
B、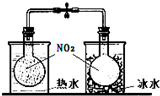 探究温度对2NO2?N2O4平衡影响 |
C、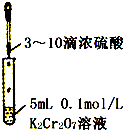 验证Cr2O72-+H2O?2CrO42-+2H+平衡状态变化 |
D、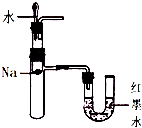 验证钠和水反应的热效应 |

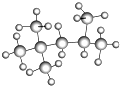 的名称(系统命名法)是
的名称(系统命名法)是