题目内容
A、B、C、D、E、F六种原子序数依次增大的短周期元素.A与其余五种元素既不同周期,也不同主族;B、C、D、E、F五种元素分别位于五个相邻的主族,原子序数之和为54,其中B的单质为空气中的主要成分之一.
(1)A、B形成的化合物液态时可发生微弱电离,电离产生的阴离子的电子式为 .
(2)某含F的盐矿石的组成可以看作其氧化物中有
的F被E替换,再由D平衡其电荷形成的.该矿石的化学式为 .(用氧化物形式表示)
(3)工业中制备单质E的阳极电极反应式: .
(1)A、B形成的化合物液态时可发生微弱电离,电离产生的阴离子的电子式为
(2)某含F的盐矿石的组成可以看作其氧化物中有
| 1 |
| 4 |
(3)工业中制备单质E的阳极电极反应式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E、F六种原子序数依次增大的短周期元素,A与其余五种元素既不同周期,也不同主族且A的原子序数最小,则A是H元素;B、C、D、E、F五种元素分别位于五个相邻的主族,原子序数之和为54,B的单质为空气中的主要成分之一,因为原子序数之和为54,所以B必须为N元素,C元素是O元素,D元素是Mg元素,B、C、D、E、F五种元素分别位于五个相邻的主族,原子序数之和为54,E的原子序数小于F,则E是Al元素,F是Si元素.
解答:
解:A、B、C、D、E、F六种原子序数依次增大的短周期元素,A与其余五种元素既不同周期,也不同主族且A的原子序数最小,则A是H元素;B、C、D、E、F五种元素分别位于五个相邻的主族,原子序数之和为54,B的单质为空气中的主要成分之一,原子序数之和为54,所以B必须为N元素,C元素是O元素,D元素是Mg元素,B、C、D、E、F五种元素分别位于五个相邻的主族,原子序数之和为54,E的原子序数小于F,则E是Al元素,F是Si元素,
(1)A、B形成的化合物是NH3,液态时可发生微弱电离,液氨电离方程式为NH3+NH3?NH4++NH2-,电离产生的阴离子的电子式为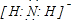 ,故答案为:
,故答案为: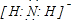 ;
;
(2)某含Si的盐矿石的组成可以看作其氧化物中有
的Si被Al替换,再由Mg平衡其电荷形成的,
二氧化硅中硅的化合价是+4价,铝在化合物中是+3价,镁在化合物中是+2价,二氧化硅的化学式为SiO2,有
的Si被铝原子取代,设镁原子个数是x,根据化合价的代数和为0得,
×4+
×3+2x=2×2,x=
,则该化学式中硅、铝、镁、氧原子个数之比=
:
:
:2=6:2:1:16,所以其化学式为MgO.Al2O3.6SiO2,
故答案为:MgO.Al2O3.6SiO2;
(3)工业中上,电解Al2O3制备单质Al,阴离子在阳极放电:2O2--4e-=O2↑;
故答案为:2O2--4e-=O2↑.
(1)A、B形成的化合物是NH3,液态时可发生微弱电离,液氨电离方程式为NH3+NH3?NH4++NH2-,电离产生的阴离子的电子式为
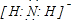 ,故答案为:
,故答案为: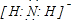 ;
;(2)某含Si的盐矿石的组成可以看作其氧化物中有
| 1 |
| 4 |
二氧化硅中硅的化合价是+4价,铝在化合物中是+3价,镁在化合物中是+2价,二氧化硅的化学式为SiO2,有
| 1 |
| 4 |
| 3 |
| 4 |
| 1 |
| 4 |
| 1 |
| 8 |
| 3 |
| 4 |
| 1 |
| 4 |
| 1 |
| 8 |
故答案为:MgO.Al2O3.6SiO2;
(3)工业中上,电解Al2O3制备单质Al,阴离子在阳极放电:2O2--4e-=O2↑;
故答案为:2O2--4e-=O2↑.
点评:本题考查了物质的性质,正确推断元素是解本题关键,难点是(3)中化学式的判断,要结合电荷守恒分析解答,注意要分情况分析,很多同学往往没有想到分情况分析而导致错误,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列各组离子可以在溶液中大量共存的是( )
| A、K+、Mg2+、SO42-、OH- |
| B、Na+、H+、Cl-、HCO3- |
| C、K+、Ag+、NO3-、Cl- |
| D、K+、Cu2+、SO42-、NO3- |
下列分子式表示的物质一定是纯净物的是( )
| A、CH4 |
| B、C2H6O |
| C、C6H12O6 |
| D、C2H4Cl2 |