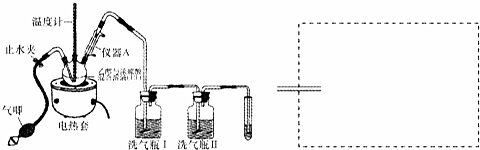
题目内容
10.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 某密闭容器盛有0.1molN2和0.3molH2,充分反应后,形成的N-H键数目为0.6NA | |
| B. | 若由CO2和O2组成的混合物共有NA个分子,则其中所含的氧原子数为2NA | |
| C. | 常温下,1L0.1mol/LNH4NO3溶液中的氢原子数为0.4NA | |
| D. | 氢氧燃料电池正极消耗22.4L气体(标况下)时,电路中通过的电子数目为2NA |
分析 A、合成氨的反应为可逆反应;
B、二氧化碳和氧气分子中均含2个氧原子;
C、硝酸铵溶液中,除了硝酸铵含有H原子,水也含H原子;
D、氢氧燃料电池中正极上放电的是氧气.
解答 解:A、合成氨的反应为可逆反应,故不能进行彻底,则生成的N-H键的个数小于0.6NA个,故A错误;
B、二氧化碳和氧气分子中均含2个氧原子,故NA个混合物分子中含有的氧原子个数为2NA个,故B正确;
C、硝酸铵溶液中,除了硝酸铵含有H原子,水也含H原子,故溶液中含有的氢原子的个数多于0.4NA个,故C错误;
D、氢氧燃料电池中正极上放电的是氧气,故当正极上消耗22.4L氧气即1mol氧气时,转移4NA个电子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
10.下列说法不正确的是( )
| A. | 天津港爆炸案中对剧毒的氯化钠(NaCN)喷洒双氧水消毒,是利用了双氧水的氧化性 | |
| B. | 碳酸钙分解、氢氧化钡晶体和氧化铵固体反应,高温下铝与氧化铁反应都是吸热反应 | |
| C. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材料 | |
| D. | 屠呦呦女士利用乙醚萃取青蒿素获得了2015年度诺贝尔生理学或医学奖,为人类防治疟疾作出了重大贡献 |
18.下列微粒中各原子的最外层电子数均满足8电子的是( )
| A. | CCl4 | B. | H2O | C. | He | D. | Al |
5.有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数).下列说法正确的是( )
| A. | 若HnXOm为强酸,则X的氢化物溶于水一定显酸性 | |
| B. | 若X(OH)n为强碱,则Y(OH)n也一定为强碱 | |
| C. | 若X元素形成的单质是X2,则Y元素形成的单质也一定是Y2 | |
| D. | 若Y的最高正化合价为+m,则X的最高正化合价一定为+m |
2.下列反应中能量变化与其它三个不同的是( )
| A. | 铝热反应 | B. | 燃料燃烧 | ||
| C. | 酸碱中和反应 | D. | Ba(OH)2•8H2O与NH4Cl固体混合 |
20.下列指定的比值为2:1的是( )
| A. | 0.2 mol/L 和0.1 mol/L的氨水中c(OH-)之比 | |
| B. | H2S溶液中c(H+)与c(S2-)之比 | |
| C. | Na2S溶液中c(Na+)与c(S2-)之比 | |
| D. | Na2O2晶体中阳离子与阴离子个数之比 |
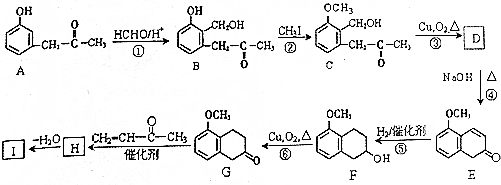
 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2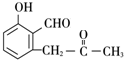 +2H2O.
+2H2O.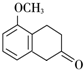 +
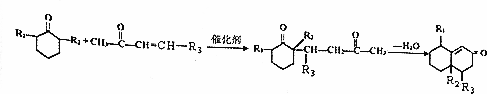
+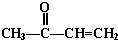 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$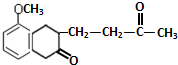 .
.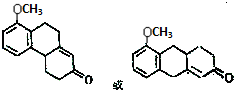 .
.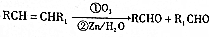 )
)