题目内容
4.下列说法正确的是( )| A. | As的原子半径大于P,AsH3比PH3的热稳定性强 | |
| B. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 | |
| C. | Al2O3和MgO均可与NaOH溶液反应 | |
| D. | SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4 |
分析 A.非金属性强的,对应氢化物稳定;
B.非金属性强的,对应最高价含氧酸的酸性越强;
C.MgO与NaOH不反应;
D.SO2气体通入Ba(NO3)2溶液,发生氧化还原反应生成硫酸钡.
解答 解:A.As的原子半径大于P,非金属性P>As,AsH3比PH3的热稳定性弱,故A错误;
B.P的非金属性强于Si,H3PO4比H2SiO3的酸性强,故B正确;
C.MgO与NaOH不反应,Al2O3与NaOH溶液反应,故C错误;
D.SO2气体通入Ba(NO3)2溶液,发生氧化还原反应生成硫酸钡,则SO2和SO3混合气体通入Ba(NO3)2溶液均可得到BaSO4,故D错误;
故选B.
点评 本题考查元素周期律和周期表的综合应用,为高频考点,把握元素的位置、性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.

练习册系列答案
相关题目
14.某学生欲测定未知物质的量浓度的氢氧化钠溶液:准确称取3.90g烧碱样品,将样品配成250mL待测液,用0.2000mol•L-1标准盐酸滴定待测烧碱溶液选择酚酞作指示剂.请填写下列空白:
(1)用标准的盐酸滴定待测的氢氧化钠溶液时,左手控制酸式滴定管活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化.直到因加入一滴盐酸,溶液的颜色由红色变为无色,且在半分钟内不变色,即停止滴定.
(2)根据下列数据,计算待测烧碱溶液的浓度:0.4000mol•L-1.
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是DE(填序号).
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出.
(1)用标准的盐酸滴定待测的氢氧化钠溶液时,左手控制酸式滴定管活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化.直到因加入一滴盐酸,溶液的颜色由红色变为无色,且在半分钟内不变色,即停止滴定.
(2)根据下列数据,计算待测烧碱溶液的浓度:0.4000mol•L-1.
| 滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 0.70 | 23.70 |
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出.
12.下列说法正确的是( )
| A. | 等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等 途径a:Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀H_{2}SO_{4}}{→}$CuSO4; 途径b:Cu$→_{△}^{浓H_{2}SO_{4}}$CuSO4 | |
| B. | Al2O3和MgO均可与NaOH溶液反应 | |
| C. | 78gNa2O2中存在的共价键总数为NA(NA为阿伏伽德罗常数的值) | |
| D. | 18gD2O中含有的质子数为10NA(NA为阿伏伽德罗常数的值) |
16.对于烃, 的命名正确的是( )
的命名正确的是( )
 的命名正确的是( )
的命名正确的是( )| A. | 2,4,4-三甲基戊烷 | B. | 2,4-二甲基戊烷 | ||
| C. | 2,2,4-三甲基戊烷 | D. | 4,4-二甲基己烷 |
14.下列元素中,其中一种与其他三种不属于同一周期的是( )
| A. | Be | B. | Ar | C. | O | D. | Li |


 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2 +2H2O.
+2H2O. +
+ $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ .
. .
. )
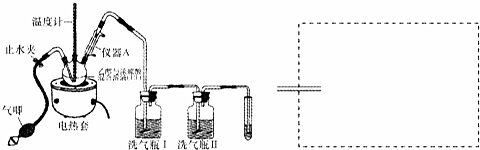
)
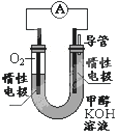 甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.
甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.