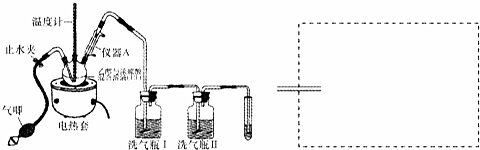
题目内容
14.氮化铝(AlN)是一种新型无机非金属材料.某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下实验方案.(1)实验原理:AlN溶于浓的强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式AlN+NaOH+H2O=NaAlO2+NH3↑
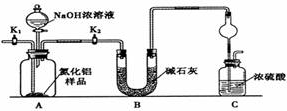
(2)实验装置:
如图C装置中球形干燥管的作用是防止倒吸.
(3)实验过程:
①连接好实验装置,检验装置的气密性.然后称得C装置的质量为yg.
②秤取xgAlN样品置于A装置中:塞好胶塞,关闭K1,打开K2(填“K1”或“K2”);通过分液漏斗加入NaOH浓溶液,至不再产生气体,打开K1,通入氮气一段时间,称得C装置的质量变为zg.装置B的作用是干燥氨气.
(4)数据分析:AlN的质量分数为$\frac{41(z-y)}{17x}$×100%(相对原子质量Al:27,N:14)
(5)Al(OH)3可添加到塑料中作阻燃剂的原因(写方程式)是2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.
分析 从实验装置和实验步骤上看,用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,从而求得AlN的质量分数,
(1)根据题目信息:AlN溶于强碱溶液时会生成NH3来书写方程式;
(2)氨气极易溶于水和浓硫酸发生反应,C装置中球形干燥管可以防止倒吸;
(3)利用装置生成气体,测定气体质量完成含量测定,装置必须密闭不漏气;用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,故应关闭活塞K1,打开活塞K2;装置中残留部分氨气,打开K1,通入氮气一段时间,用氮气把装置内生成的氨气全部赶到浓硫酸中被吸收,装置B是吸收氨气中的水蒸气;
(4)①根据氮原子的守恒,氨气的物质的量等于AlN的物质的量,可求得AlN的质量分数;
②氢氧化铝分解吸热生成熔点高的氧化铝阻燃.
解答 解:(1)根据题目信息:AlN溶于强碱溶液时会生成NH3,化学方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑,
故答案为:AlN+NaOH+H2O=NaAlO2+NH3↑;
(2)氨气极易溶于水和浓硫酸发生反应,C装置中球形干燥管上部面积较大可以防止倒吸,避免产生危险,导致测定结果不准确,
故答案为:防止倒吸;
(3)利用装置生成气体,测定吸收气体质量来完成含量测定,装置必须密闭不漏气,连接好实验装置,先检验装置的气密性,然后称得C装置的质量为yg为吸收氨气的质量,
②用足量NaOH溶液与样品中AlN完全反应,充分吸收生成的氨气,并称量其质量,故应关闭活塞K1,打开活塞K2,使生成的氨气被浓硫酸全部吸收,通过分液漏斗加入NaOH浓溶液,至不再产生气体.打开K1,通入氮气一段时间,称得C装置的质量变为zg.通入氮气的目的是把装置中残留的氨气全部赶入C装置,使氨气被充分吸收,避免氨气中的水蒸气影响测定结果,通过装置B中的碱石灰吸收水蒸气,对氨气进行干燥,
故答案为:K1;K2;干燥氨气;
(4)①氨气的质量为(z-y)g,物质的量为$\frac{z-y}{17}$mol,根据氮原子的守恒,氨气的物质的量等于AlN的物质的量,所以AlN的质量为$\frac{z-y}{17}$mol×41g/mol=$\frac{41(x-y)}{17}$g,故AlN的质量分数为$\frac{\frac{41(z-y)}{17}}{x}$×100%=$\frac{41(z-y)}{17x}$×100%,
故答案为:$\frac{41(z-y)}{17x}$×100%;
②氢氧化铝分解吸热生成熔点高的氧化铝阻燃,反应的化学方程式为:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O,
故答案为:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3H2O.
点评 本题是一道关于物质的组成和含量测定知识的综合考查题,要求学生具有分析和解决问题的能力,题目难度中等.

用4mL0.001mol/LKMnO4溶液与2mL0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响.改变的条件如下:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2mL | 20 | / |
| Ⅱ | 2mL | 30 | / |
| Ⅲ | 1mL | 20 | 1mL蒸馏水 |
| Ⅳ | A | 20 | B |
(2)如果研究温度对化学反应速率的影响,使用实验Ⅰ、Ⅱ (用Ⅰ~Ⅳ表示,下同).
(3)对比实验Ⅰ和Ⅲ,可以研究浓度对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是确保溶液总体积不变.
(4)在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速度加快.从影响化学反应速率的因素看,你猜想反应速率明显加快的原因还可能是催化剂(或锰离子的催化作用)的影响.
A.2mL B.硫酸锰.
| A. | 若HnXOm为强酸,则X的氢化物溶于水一定显酸性 | |
| B. | 若X(OH)n为强碱,则Y(OH)n也一定为强碱 | |
| C. | 若X元素形成的单质是X2,则Y元素形成的单质也一定是Y2 | |
| D. | 若Y的最高正化合价为+m,则X的最高正化合价一定为+m |
| A. | 铝热反应 | B. | 燃料燃烧 | ||
| C. | 酸碱中和反应 | D. | Ba(OH)2•8H2O与NH4Cl固体混合 |
| A. | 原子半径:Br>Se>Cl | B. | 热稳定性:HF>HCl>H2S | ||
| C. | 还原性:S2->Se2->Cl- | D. | 酸性:HBrO4>HClO4>H2SO4 |
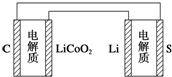 已知:锂离子电池的总反应为LixC+Li1-xCoO2$?_{充电}^{放电}$C+LiCoO2锂硫电池的总反应为2Li+S$?_{充电}^{放电}$Li2S有关上述两种电池说法正确的是( )
已知:锂离子电池的总反应为LixC+Li1-xCoO2$?_{充电}^{放电}$C+LiCoO2锂硫电池的总反应为2Li+S$?_{充电}^{放电}$Li2S有关上述两种电池说法正确的是( )| A. | 锂离子电池放电时,Li+向负极迁移 | |
| B. | 锂硫电池充电时,锂电极发生氧化反应 | |
| C. | 理论上两种电池的比能量相同 | |
| D. | 下图表示用锂硫电池给锂离子电池充电 |
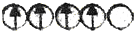 ,而不排布成
,而不排布成 ,其直接的根据是( )
,其直接的根据是( )| A. | 能量最低原理 | B. | 洪特规则 | C. | 原子轨道能级图 | D. | 泡利不相容原理 |
| A. | 分馏石油气和裂解气可用溴水进行鉴别 | |
| B. | 异丁烷的二氯取代物有3种(不考虑立体异构) | |
| C. | 主链含四个碳的烷烃中,碳原子个数是最多的是2,3-四甲基丁烷 | |
| D. | 乙醇和甘油都含羟基,葡萄糖和蔗糖都是糖类,但它们之间不是同系物 |