题目内容
6.关于下列装置的说法中,不正确的是( )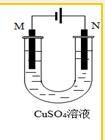
| A. | 若用于精炼粗铜,所得电解铜的纯度可达99.95%~99.98% | |
| B. | 若用于精炼粗铜,在N极附近得到阳极泥,可作为提炼金、银等贵重金属的原料 | |
| C. | 若用于精炼粗铜,则M极为粗铜 | |
| D. | 若用于铁片镀铜,则M极为铁片 |
分析 电解池中与正极相连的为阳极,与负极相连的为阴极;电镀法精炼铜时,粗铜为阳极,精铜为阴极,阳极材料是粗铜,阳极上金属失电子变成离子进入溶液,Cu-2e-=Cu2+,比金属铜活泼的金属锌、铁、镍会先于金属铜失电子,比金属铜活泼性差的Pt、Ag等固体会沉积下来形成阳极泥,这样最终电解铜的纯度可达99.95%~99.98%,根据进行解答.
解答 解:A.通过电解精炼粗铜,得到铜的纯度较高,可达99.95%~99.98%,故A正确;
B.N为阳极,阳极上金属失电子变成离子进入溶液,比金属铜活泼性差的Pt、Ag等固体会沉积下来形成阳极泥,可作为提炼金、银等贵重金属的原料,故B正确;
C.电解精炼铜时,粗铜做阳极,则N极为粗铜,故C错误;
D.用于铁片镀铜,镀件作阴极,则M极为铁片,D正确;
故选C.
点评 本题考查了电解原理及应用,题目难度不大,涉及电解精炼铜、电镀等知识,明确电解原理为解答关键,试题侧重基础知识的考查,培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
17.NA表示阿伏加德罗常数的数值,下列判断正确的是 ( )
| A. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| B. | 常温常压下,22.4LCO2中含有的CO2分子数为NA个 | |
| C. | 等物质的量的N2和CO的质量均为28g | |
| D. | 常温下,1L 0.1mol/LNa2CO3溶液中,含有阴离子的总数大于0.1NA |
14. 甲~辛等元素在周期表中的相对位置如右表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如右表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
 甲~辛等元素在周期表中的相对位置如右表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如右表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )| A. | 金属性:甲>乙>丁 | |
| B. | 最高价氧化物水化物酸性:戊<己 | |
| C. | 丙与庚的原子核外电子数相差13 | |
| D. | 乙的单质在空气中燃烧生成只含离子键的化合物 |
18.标准状况下,1体积水可溶解448体积的HCl 气体,制得的盐酸溶液密度为1.2g•mL-1,所得溶液的物质的量浓度为( )
| A. | 1.16 mol•L-1 | B. | 6.8 mol•L-1 | C. | 13.9 mol•L-1 | D. | 20.0 mol•L-1 |
15.下列说法正确的是( )
| A. | 蔗糖、淀粉、油脂及其水解产物均为非电解质 | |
| B. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| C. | 糖类、油脂、蛋白质都是天然的高分子化合物 | |
| D. | 苯、油脂均不能使酸性KMnO4溶液褪色 |



 RCHO+R′CHO (R、R′代表烃基或氢)
RCHO+R′CHO (R、R′代表烃基或氢) b.
b. c.
c.
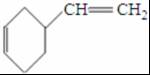 .
.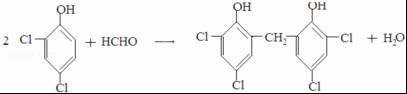 .
.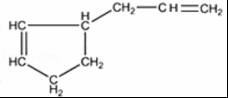 .
.