题目内容
18.标准状况下,1体积水可溶解448体积的HCl 气体,制得的盐酸溶液密度为1.2g•mL-1,所得溶液的物质的量浓度为( )| A. | 1.16 mol•L-1 | B. | 6.8 mol•L-1 | C. | 13.9 mol•L-1 | D. | 20.0 mol•L-1 |
分析 先根据n=$\frac{V}{{V}_{m}}$计算出氯化氢的物质的量,再根据m=nM计算出氯化氢的质量,从而可得出溶液质量,然后根据V=$\frac{m}{ρ}$计算出该溶液体积,最后根据c=$\frac{n}{V}$计算出所得溶液的物质的量浓度.
解答 解:设水的体积为1L,HCl的体积为448L,标准状况下HCl的物质的量为:$\frac{448L}{22.4L/mol}$=20mol,氯化氢的质量为:36.5g/mol×20mol=730g,
1L水的质量约为1000g,则所得溶液的质量为:1000g+730g=1730g,
所得溶液体积为:$\frac{1730g}{1.2g/mL}$≈1441.67mL≈1.44L,
则所得溶液的物质的量浓度为:c(HCl)=$\frac{20mol}{1.44L}$≈13.9 mol•L-1,
故选C.
点评 本题考查了物质的量浓度的计算,题目难度中等,正确计算溶液体积为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
9.下列物质的转化在给定条件下能实现的是( )
| A. | S$\stackrel{O_{2}点燃}{→}$ SO3$\stackrel{足量氨水}{→}$(NH4)2SO4 | |
| B. | NH3$→_{加热}^{O_{2}/催化剂}$NO$\stackrel{O_{2}}{→}$ NO2 | |
| C. | Fe$→_{加热}^{少量Cl_{2}}$ FeCl2$→_{溶液}^{NaOH溶液}$Fe(OH)2 | |
| D. | Al$→_{溶液}^{NaOH溶液}$ NaAlO2$\stackrel{足量盐酸}{→}$Al(OH)3 |
6.关于下列装置的说法中,不正确的是( )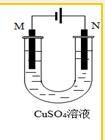

| A. | 若用于精炼粗铜,所得电解铜的纯度可达99.95%~99.98% | |
| B. | 若用于精炼粗铜,在N极附近得到阳极泥,可作为提炼金、银等贵重金属的原料 | |
| C. | 若用于精炼粗铜,则M极为粗铜 | |
| D. | 若用于铁片镀铜,则M极为铁片 |
13.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.
(1)B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O.
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的,所以溶液变红.
(3)为了探究现象Ⅱ的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.资料显示:SCN-的电子式为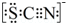 .
.
①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成.
④若SCN-与Cl2反应生成1mol CO2,写出反应离子方程式SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+Cl-+18H+,并计算转移电子的物质的量是16mol.
| 操 作 | 现 象 |
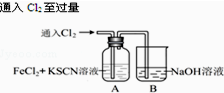 | I.A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的,所以溶液变红.
(3)为了探究现象Ⅱ的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.资料显示:SCN-的电子式为
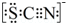 .
.①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成.
④若SCN-与Cl2反应生成1mol CO2,写出反应离子方程式SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+Cl-+18H+,并计算转移电子的物质的量是16mol.
10.某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+.取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.由此可知原溶液中( )
| A. | Cl-一定存在,且c(Cl-)≥0.4 mol/L | |
| B. | SO42-、NH4+一定存在,Cl-可能不存在 | |
| C. | CO32-、Al3+一定不存在,K+可能存在 | |
| D. | 至少存在5种离子 |
7.下列物质属于天然纤维且其主要成分是纤维素的是( )
| A. | 棉花 | B. | 光导纤维 | C. | 人造棉 | D. | 蚕丝 |
8.某元素位于周期表中的ⅣA族,它是良好的半导体材料,其金属性比非金属性强,所以通常认为它是金属元素.此元素可能是( )
| A. | Si | B. | Ge | C. | Sn | D. | Pb |
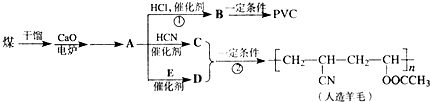
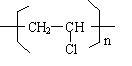 ,CH2C═CH-CN.
,CH2C═CH-CN.