��Ŀ����
16�������ƾ��壨Na2MoO4•2H2O������������ȴˮϵͳ�Ľ�����ʴ�������⾫����Ҫ�ɷ���MoS2��������PbS�ȣ��Ʊ������ƾ���IJ���������ͼ��ʾ��
��1��Na2MoO4•2H2O����Ԫ�صĻ��ϼ�Ϊ+6��
��2������ʱΪ��ʹ�⾫���ַ�Ӧ���ɲ�ȡ�Ĵ�ʩ�ǽ���ʯ���飨�����ӿ����Ľ��������������ԭ���ȣ������һ�����ɣ���
��3�����չ������⾫��������Ҫ��Ӧ�Ļ�ѧ����ʽΪMoS2+O2$\stackrel{��}{��}$MoO3+SO2��δ��ƽ�����÷�Ӧ������������MoO3��SO2���ѧʽ����������1molSO2ʱ���÷�Ӧת�Ƶĵ��ӵ����ʵ���Ϊ7mol�������в�����SO2�������Ϊ����ҵ�������ԭ���������һ�����ɣ���
��4�����ʱ��MoO3��Na2CO3��Һ��Ӧ�����ӷ���ʽΪMoO3+CO32-=MoO42-+CO2����
��5���ؽᾧ�õ���ĸҺ�������´��ؽᾧʱ�ظ�ʹ�ã����ﵽһ����������뾻��������ԭ��ʹ�ö�κ�ĸҺ�����ʵ�Ũ�������ؽᾧʱ���������ʣ�Ӱ���Ʒ���ȣ�
��6�����˺�ļ��Һ�ᾧǰ�����Ba��OH��2�����Գ�ȥSO42-����BaMoO4��ʼ����ʱ��
SO42-��ȥ����Ϊ97.5%����֪���Һ��c��MoO42-��=0.40mol•L-1��c��SO42-��=0.040mol•L-1��Ksp��BaSO4��=1.0��10-10����Ksp��BaMoO4��=4.0��10-8[����Ba��OH��2�����������Һ����仯�ɺ���]��
���� �����⾫��MoS2ȼ�գ���Ӧ����ʽΪ2MoS2+7O2$\frac{\underline{\;\;��\;\;}}{\;}$2MoO3+4SO2�����������£�MoO3��Na2CO3��Һ��Ӧ����Ӧ����ʽΪMoO3+CO32-=MoO42-+CO2����Ȼ������Һ�м����������ȥ�ؽ������ӣ���Һ�е�����ΪNa2MoO4������Һ����Ũ������ȴ�ᾧ��Ȼ���ؽᾧ�õ�Na2MoO4.2H2O��
��1�������ڻ��������������ϼ۴�����Ϊ�㣬��������ƣ�Na2MoO4•2H2O���Ļ�ѧʽ���н���⣻
��2������ʱΪ��ʹ�⾫���ַ�Ӧ�����⾫���������Ӵ�������������������������Ӧ��Ӵ�ʱ��Խ������ӦԽ��֣�
��3�����չ������⾫��������Ҫ��Ӧ�Ļ�ѧ����ʽΪ��2MoS2+7O2$\frac{\underline{\;\;��\;\;}}{\;}$2MoO3+4SO2��Ԫ�ػ��ϼ����ߵ�ʧȥ���ӷ���������Ӧ�õ�����������ݻ�ѧ����ʽ������ϵ�������ת�����ʵ���������������Դ���������������������ˮ�������
��4�����������£�MoO3��Na2CO3��Һ��Ӧ���ɶ�����̼�������ƣ�
��5��ʹ�õĴ����϶��ĸҺ�����ʵ�Ũ������Ӱ���Ʒ���ȣ�
��6���������ᱵ�����ᱵ���ܶȻ������ʾ����Һ����������ӵ�Ũ�ȣ������ݼ����SO42-��ȥ���ʼ���õ��ܶȻ���
��� �⣺��1������ᾧˮ��������������Ԫ�صĻ��ϼ�ֻ����Na2MoO4����Ԫ�صĻ��ϼۼ��ɣ���Ԫ����+1����Ԫ����-2������Ԫ�صĻ��ϼ���x�������ڻ��������������ϼ۴�����Ϊ�㣬��֪�����ƣ�Na2MoO4•2H2O������Ԫ�صĻ��ϼۣ���+1����2+x+��-2����4=0����x=+6��
�ʴ�Ϊ��+6��
��2����Ӧ��Ӵ�ʱ��Խ������ӦԽ��֣����յĹ����в��á��������ա��Ĵ�ʩ�������ʯ�����ӿ���ͨ�����ȣ������⾫��������Ӵ���ʹ���ַ�Ӧ�����ԭ�ϵ������ʣ�
�ʴ�Ϊ������ʯ���飨�����ӿ����Ľ��������������ԭ���ȣ���
��3�����չ������⾫��������Ҫ��Ӧ�Ļ�ѧ����ʽΪ��2MoS2+7O2$\frac{\underline{\;\;��\;\;}}{\;}$2MoO3+4SO2��Ԫ�ػ��ϼ����ߵ�ʧȥ���ӷ���������Ӧ�õ����������Ӧ��MoԪ�ػ��ϼ�+2�۱仯Ϊ+6�ۣ���Ԫ�ػ��ϼ�-1�۱仯Ϊ+4�ۣ��÷�Ӧ������������MoO3��SO2����Ӧ������4mol�����������ת��28mol��������1mol�����������ת��Ϊ7mol������������Դ���������������������ˮ�������ᣬ�����в�����SO2�ڹ�ҵ����������ԭ�������Ϊ����
�ʴ�Ϊ��MoO3��SO2��7����ҵ�������ԭ������
��4�����������£�MoO3��Na2CO3��Һ��Ӧ���ɶ�����̼�������ƣ����ӷ���ʽΪMoO3+CO32-=MoO42-+CO2����
�ʴ�Ϊ��MoO3+CO32-=MoO42-+CO2����
��5������ʹ�õĴ����϶��ĸҺ�����ʵ�Ũ������Ӱ���Ʒ���ȣ����Խ��б��뾻��������
�ʴ�Ϊ��ʹ�ö�κ�ĸҺ�����ʵ�Ũ�������ؽᾧʱ���������ʣ�Ӱ���Ʒ���ȣ�
��6����BaMoO4��ʼ����ʱ��Һ�б�����Ũ��c��Ba2+��=$\frac{Ksp��BaMn{O}_{4}��}{c��Mn{{O}_{4}}^{-}��}$=$\frac{Ksp��BaMo{O}_{4}��}{0.4mol/L}$��
��Һ�����������Ũ��c��SO42-��=$\frac{Ksp��BaS{O}_{4}��}{c��B{a}^{2+}��}$��
SO42-��ȥ����Ϊ97.5%��1-$\frac{Ksp��BaS{O}_{4}��}{c��B{a}^{2+}��}$=97.5%
1-$\frac{1.0��1{0}^{-10}}{\frac{Ksp��BaMo{O}_{4}��}{0.4mol/L}}$=97.5%
Ksp��BaMoO4��=4.0��10-8��
�ʴ�Ϊ��4.0��10-8��
���� ���⿼�������ʷ�����ᴿ�ķ����ͻ��������ۺ�Ӧ�ã���Ҫ�Ƿ����ᴿ�ķ������������ʵķ���Ӧ�ã��ܶȻ������ļ����֪ʶ�����ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�

| �� ���� | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | �� | |||||||
| 3 | �� | �� | �� | �� | �� | �� | ||
| 4 | �� | �� | �� |
��1���ڢ١���Ԫ���У�ԭ�Ӱ뾶������K����Ԫ�ط��ţ���
��2���١�����Ԫ������������Ӧ��ˮ������������ǿ����HClO4�������ʻ�ѧʽ����������ӦԪ�صĵ��ʹ�ҵ�Ʊ�����Ϊ2Al2O3$\frac{\underline{\;ͨ��\;}}{\;}$4Al+3O2����
��3���õ���ʽ��ʾԪ�آ�����γɻ�����Ĺ���
 ��
����4���ҹ��״��Ե��ʢ�-����-��ˮ�����Ϊ��Դ�����͵ĺ�ˮ��־�ƣ��Ժ�ˮΪ�������Һ���������е�����ʹ���ʢݲ�������������������ֻҪ�ѵƷ��뺣ˮ�����ӣ��ͻᷢ��ҫ�۵İ⣮���Դ�ĸ�����Ӧ��4Al-12e-=4Al3+��������ӦΪ3O2+6H2O+12e-=12OH-��
| A�� | 3�� | B�� | 4�� | C�� | 5�� | D�� | 6�� |
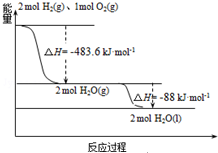 �����õ����ػ��ʹ�õ�����Һ��Ϊȼ�ռ���Һ��Ϊ�������ĸ��ܵ����ƽ�������֪��
�����õ����ػ��ʹ�õ�����Һ��Ϊȼ�ռ���Һ��Ϊ�������ĸ��ܵ����ƽ�������֪����1��H2��g���TH2��l����H1=-0.92kJ•mol-1
��2��O2��g���TO2��l����H2=-6.84kJ•mol-1
����˵����ȷ���ǣ�������
| A�� | H2��g����O2��g����Ӧ����H2O��g������483.6kJ•mol-1 | |
| B�� | ������ȼ����Ϊ��H=-241.8 kJ•mol-1 | |
| C�� | �����Һ��ȼ�յ��Ȼ�ѧ����ʽΪ��2H2��l��+O2��l���T2H2O��g����H=-474.92kJ•mol-1 | |
| D�� | H2O��g��=H2O��l����H=-88kJ•mol-1 |
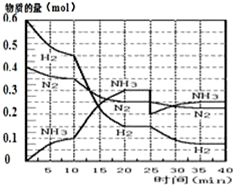 ���ĺϳ�ԭ��Ϊ��N2��g��+3H2��g��?2NH3��g������H=-92.4KJ•mol-1������500�桢20MPaʱ����N2��H2����һ���ݻ�Ϊ2L���ܱ������з�����Ӧ����Ӧ�����и����ʵ����ʵ����仯��ͼ��
���ĺϳ�ԭ��Ϊ��N2��g��+3H2��g��?2NH3��g������H=-92.4KJ•mol-1������500�桢20MPaʱ����N2��H2����һ���ݻ�Ϊ2L���ܱ������з�����Ӧ����Ӧ�����и����ʵ����ʵ����仯��ͼ���ش��������⣺
��1��10min����NH3��ʾ��ƽ����Ӧ����0.005mol/��L��min����
��2����10��20min�ڣ�NH3Ũ�ȱ仯��ԭ�������A��
A�����˴��� B����С�������
C�������¶� D������NH3���ʵ���
��3����1��ƽ���ʱ�䷶ΧΪ��20-25min����1��ƽ�⣺ƽ�ⳣ��K1=$\frac{��\frac{0.3mol}{2L}��^{2}}{��\frac{0.25mol}{2L}����\frac{0.15mol}{2L}��^{3}}$�������ݵı���ʽ����
��4���ڷ�Ӧ������25minʱ��
�����߷����仯��ԭ�����0.1molNH3
�ڴ�ڶ���ƽ��ʱ����ƽ���ƽ�ⳣ��K2����K1������ڡ��������ڡ�����С�ڡ�����
��5���������¡��˹��̵������о��������ڳ��¡���ѹ�����������£�N2�ڴ�������������Fe2O3��TiO2��������ˮ�������з�Ӧ��
N2��g��+3H2O��1��?2NH3��g��+$\frac{3}{2}$O2��g������H=a kJ•mol-1
��һ���о�NH3���������¶ȵĹ�ϵ����ѹ�´ﵽƽ��ʱ��ò���ʵ���������±���
| T/K | 303 | 313 | 323 |
| NH3������/��10-6mol�� | 4.8 | 5.9 | 6.0 |
����֪��N2��g��+3H2��g��?2NH3��g����H=-92.4kJ•mol-1
2H2��g��+O2��g���T2H2O��l����H=-571.6kJ•mol-1
�����µ�����ˮ��Ӧ���ɰ������������Ȼ�ѧ����ʽΪ��2N2��g��+6H2O��l��=4NH3��g��+3O2��g����H=+1530kJ•mol-1��
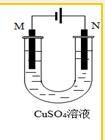
| A�� | �����ھ�����ͭ�����õ��ͭ�Ĵ��ȿɴ�99.95%��99.98% | |
| B�� | �����ھ�����ͭ����N�������õ������࣬����Ϊ���������ȹ��ؽ�����ԭ�� | |
| C�� | �����ھ�����ͭ����M��Ϊ��ͭ | |
| D�� | ��������Ƭ��ͭ����M��Ϊ��Ƭ |

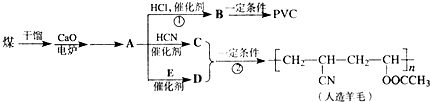
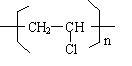 ��CH2C�TCH-CN��
��CH2C�TCH-CN��