题目内容
取含有 0.02mol 的硫酸溶液,先投入 0.24g 镁粉,再滴入NaOH 溶液,当使溶液中的镁离子全部转化为沉淀时,需要NaOH的物质的量为( )
| A、0.02mol |
| B、0.03mol |
| C、0.04mol |
| D、0.01mol |
考点:化学方程式的有关计算
专题:计算题
分析:向反应后的溶液中加入氢氧化钠溶液,溶液中的镁离子全部转化为氢氧化镁沉淀时,此时溶液中溶质为Na2SO4,根据硫酸根守恒n(Na2SO4)=n(H2SO4),根据钠离子守恒n(NaOH)=2n(Na2SO4),据此计算.
解答:
解:向反应后的溶液中加入氢氧化钠溶液,溶液中的镁离子全部转化为氢氧化镁沉淀时,此时溶液中溶质为Na2SO4,根据硫酸根守恒n(Na2SO4)=n(H2SO4)=0.02mol,根据钠离子守恒n(NaOH)=2n(Na2SO4)=0.02mol×2=0.04mol,
故选C.
故选C.
点评:本题考查化学方程式计算,比较基础,明确发生的反应是关键,注意利用守恒思想解答.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
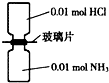 NA表示阿伏加德罗常数的值,常温下,抽去如图所示装置中的玻璃片,使两种气体充分反应.下列说法正确的是( )
NA表示阿伏加德罗常数的值,常温下,抽去如图所示装置中的玻璃片,使两种气体充分反应.下列说法正确的是( )| A、反应前气体的总体积为0.448L |
| B、生成物中含有0.01NA个分子 |
| C、装置中氢元素的总质量为0.04g |
| D、生成物完全溶于水后所得溶液含有0.01NA个NH4+ |
在给定条件的水溶液中一定能大量共存的离子组是( )
| A、含有SO42-的溶液:Ca2+、NH4+、HCO3-、Cl- |
| B、c(Fe2+)=0.5 mol/L的溶液:H+、Na+、Cl-、SO42- |
| C、pH=1的溶液:Na+、K+、Cl-、CO32- |
| D、酸性无色透明溶液中:Fe2+、Na+、NO3-、CO32- |
下列实验操作或装置符合实验要求的是( )
A、 用如图装置可用于分离互不相溶的液体 |
B、 用如图装置酸性KMnO4溶液中没有气泡出现,但溶液颜色会逐渐变浅乃至褪去 |
C、 用如图所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
D、 用如图确认CO2和NaOH已发生反应 |
以NA表示阿伏加德罗常数,下列说法中正确的是( )
| A、1.8g NH4+离子中含有的电子数为NA |
| B、常温常压下,1mol甲基(-CH3)所含电子数为10NA |
| C、25℃,1.01×105 Pa下,使V L氯化氢气体溶于水得V L水溶液,所得溶液的物质的量浓度为1/22.4 mol?L-1 |
| D、标准状况下,22.4 L Cl2和HCl的混合气体中含分子总数为2NA |
同温同压下,下列各组化学方程式中Q2>Q1的是( )
| A、2H2(g)+O2(g)═2H2O(l)△H=-Q1kJ/mol 2H2(g)+O2(g)═2H2O(g)△H=-Q2kJ/mol | ||||
| B、S(g)+O2(g)═SO2(g)△H=-Q1kJ/mol S(s)+O2(g)═SO2(g)△H=-Q2kJ/mol | ||||
| C、C(s)+1/2O2(g)═CO(g)△H=-Q1kJ/mol C(s)+O2(g)═CO2(g)△H=-Q2kJ/mol | ||||
D、H2(g)+Cl2(g)═2HCl(g)△H=-Q1kJ/mol
|
由C、H、O组成的化合物5.80毫克,完全燃烧后得到CO213.2毫克,H2O5.4毫克.则该化合物的化学式是( )
| A、C3H8O2 |
| B、C2H4O |
| C、C5H10O2 |
| D、C3H6O |
已知:C(s)+O2(g)═CO2(g);△H=-393.5kJ/mol;
H2(g)+
O2(g)═H2O(l);△H=-285.8kJ/mol,
现有0.2mol的炭粉和氢气组成的悬浮气,因混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比约为( )
H2(g)+
| 1 |
| 2 |
现有0.2mol的炭粉和氢气组成的悬浮气,因混合物在氧气中完全燃烧,共放出63.53kJ热量,则混合物中C与H2的物质的量之比约为( )
| A、1:2 | B、1:1 |
| C、2:5 | D、3:2 |
常温下呈气态的烷烃有( )
| A、只有4种 | B、只有5种 |
| C、多于5种 | D、无法确定 |