题目内容
19.某硬质合金厂用辉钼矿(MoS2,含有Fe2O3、Al2O3、SiO2、CuFeS2、Au)制取MoO3工艺流程如图所示.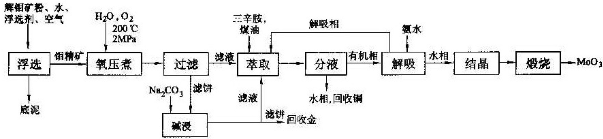
(1)向矿浆加入起泡剂充分搅拌,MoS2等附着在气泡上由刮泡器刮取,经烘干的钼精矿.该浮选的原理是利用物质的B(填选项).
A.溶解性 B.亲水性或亲油性 C.密度 D.化学性质
(2)底泥的主要成分是Fe2O3、Al2O3、SiO2.
(3)氧压煮过程中,MoS2被氧化为可溶性弱酸H2MoO4,CuFeS2被氧化为CuSO4、Fe2(SO4)3.写出MoS2被氧化为可溶性H2MoO4的化学方程式2MoS2+9O2+6H2O=2H2MoO4+4H2SO4.
(4)H2MoO4在溶液中能电离出二钼酸根(Mo2O72-)、六钼酸根(H3Mo6Oy-21)等阴离子,用三辛胺[N(CRH17)3]萃取(三辛胺难溶于水,用煤油组溶剂),再用氨水解吸,有机相可循环利用.
①H3Mo6Oy-21中y=3;
②有机相中的二钼酸三辛铵[NH(C8H17)3]2Mo2O7难电离,可用氨水解吸,分液得到二钼酸钠溶液和三辛胺的煤油溶液.该反应的离子方程式为②[NH(C8H17)3]2Mo2O7+2NH3.H2O=2 N(C8H17)3+Mo2O72-+2NH4++2H2O;
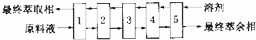
③Mo的提取为多段逆流萃取,如图为五段逆流萃取提取示意图,这种萃取提取示意图,这种萃取的优点是溶剂与原料液充分接触,有利于提高萃取率;
④最终萃取余相中含有Fe3+、Cu2+,沉淀铜的试剂可选择溶剂与原料液充分接触,有利于提高萃取率.
A.氨水 B.NaOH C.铁
(5)向解吸液中加入适量镁盐,沉淀出砷、碳等杂质并过滤除去,溶液经蒸发浓缩、结晶产出二钼酸铵,热分解制得MoO3,氨气可循环利用.该合金厂1.0×104kg辉钼矿(含0.10%MoS2)理论上生产MoO3质量为9kg.
分析 辉钼矿进行浮选得到钼精矿,(3)氧压煮过程中,MoS2被氧化为可溶性弱酸H2MoO4,CuFeS2被氧化为CuSO4、Fe2(SO4)3.过滤的滤饼用碳酸钠碱浸,再利用过滤的滤饼回收Au,说明浮选除去Fe2O3、Al2O3、SiO2.氧压煮过滤的滤液中含有H2MoO4、CuSO4、Fe2(SO4)3,将碱浸后的滤液合并,用三辛胺进行萃取,分液,水相中含有Fe3+、Cu2+,可以加入Fe回收Cu.有机相再用氨水解吸,有机相可循环,水相结晶、煅烧得到MoO3.
(1)向矿浆加入起泡剂充分搅拌,MoS2等附着在气泡上由刮泡器刮取,经烘干的钼精矿,不涉及溶解、化学变化,也不是利用密度分离,可能是利用物质的亲水性或亲油性;
(2)由上述分析可知,底泥的主要成分是Fe2O3、Al2O3、SiO2;
(3)氧压煮过程中,MoS2被氧化为可溶性弱酸H2MoO4,需要有氧气、水参与,硫元素被氧化为硫酸;
(4)①H3Mo6Oy-21中Mo的化合价与H2MoO4中相同,为+6价,根据化合价电荷数计算y的值;
②[NH(C8H17)3]2Mo2O7难电离,可用氨水解吸,分液得到二钼酸钠(Na2Mo2O7)溶液和三辛胺的煤油溶液,三辛胺为N(C8H17)3,则还生成NH4+;
③Mo的提取为多段逆流萃取,这种萃取的优点是溶剂与原料液充分接触,有利于提高萃取率;
④最终萃取余相中含有Fe3+、Cu2+,可以用Fe进行还原;
(5)根据Mo元素守恒守恒计算.
解答 解:辉钼矿进行浮选得到钼精矿,(3)氧压煮过程中,MoS2被氧化为可溶性弱酸H2MoO4,CuFeS2被氧化为CuSO4、Fe2(SO4)3.过滤的滤饼用碳酸钠碱浸,再利用过滤的滤饼回收Au,说明浮选除去Fe2O3、Al2O3、SiO2.氧压煮过滤的滤液中含有H2MoO4、CuSO4、Fe2(SO4)3,将碱浸后的滤液合并,用三辛胺进行萃取,分液,水相中含有Fe3+、Cu2+,可以加入Fe回收Cu.有机相再用氨水解吸,有机相可循环,水相结晶、煅烧得到MoO3.
(1)向矿浆加入起泡剂充分搅拌,MoS2等附着在气泡上由刮泡器刮取,经烘干的钼精矿,不涉及溶解、化学变化,也不是利用密度分离,可能是利用物质的亲水性或亲油性,
故答案为:B;
(2)由上述分析可知,底泥的主要成分是Fe2O3、Al2O3、SiO2,
故答案为:Fe2O3、Al2O3、SiO2;
(3)氧压煮过程中,MoS2被氧化为可溶性弱酸H2MoO4,需要有氧气、水参与,硫元素被氧化为硫酸,反应方程式为:2MoS2+9O2+6H2O=2H2MoO4+4H2SO4,
故答案为:2MoS2+9O2+6H2O=2H2MoO4+4H2SO4;
(4)①H3Mo6Oy-21中Mo的化合价与H2MoO4中相同,为+6价,则1×3+6×6-2×21=-y,故y=3,
故答案为:3;
②[NH(C8H17)3]2Mo2O7难电离,可用氨水解吸,分液得到二钼酸钠(Na2Mo2O7)溶液和三辛胺的煤油溶液,三辛胺为N(C8H17)3,则还生成NH4+,离子方程式为:②[NH(C8H17)3]2Mo2O7+2NH3.H2O=2 N(C8H17)3+Mo2O72-+2NH4++2H2O,
故答案为:②[NH(C8H17)3]2Mo2O7+2NH3.H2O=2 N(C8H17)3+Mo2O72-+2NH4++2H2O;
③Mo的提取为多段逆流萃取,这种萃取的优点是溶剂与原料液充分接触,有利于提高萃取率,
故答案为:溶剂与原料液充分接触,有利于提高萃取率;
④最终萃取余相中含有Fe3+、Cu2+,氨水、氢氧化钠会沉淀铁离子、铁离子,可以用Fe进行还原,
故答案为:C;
(5)设理论上生产MoO3质量为xkg,根据Mo元素守恒守恒,则:
1.0×104kg×0.10%×$\frac{96}{96+64}$=x kg×$\frac{96}{96+48}$
解得x=9
故答案为:9.
点评 本题考查物质制备、化学与技术,涉及对工艺流程的理解、陌生方程式的书写、物质的分离提纯、化学计算等,基本抛弃中学内容,是对学生综合能力的考查,属于易错题目,难度较大.

 名校课堂系列答案
名校课堂系列答案步骤①用电子天平准确称取样品1.5000g.
步骤②将样品溶解并冷却后,完全转移到250mL容量瓶中,定容,充分摇匀.
步骤③移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛,摇匀、静置5min,加入2滴酚酞试液,用NaOH标准溶液滴定到终点.重复步骤③操作2次.
(1)根据步骤③填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数将偏高 (填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积将无影响
(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察B.
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变为红色,半分钟内不褪色.
⑤滴定后俯视读数,测得样品中氮的质量分数将偏低(填“偏高”、“偏低”或“无影响”).
(2)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 2.00 | 22.00 |
| 3 | 25.00 | 0.20 | 20.21 |
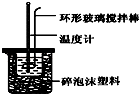 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:| 实验次数 | 起始温度t1/℃ | 起始温度t1/℃ | 终止温度t2/℃ |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(2)在操作正确的前提下,提高中和热测定准确性的关键是提高装置的保温效果.
(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=-56.8kJ/mol[盐酸和NaOH溶液的密度按1g•cm-3计算,反应后混合溶液的比热容(c)按4.18J•(g•℃)-1计算].如改用0.6mol/L的盐酸进行实验,其他情况不变,则实验中测得的“中和热”数值将不变(填“偏大”、“偏小”、“不变”).其理由是放出的热量多,生成的水也多,但中和热不变.
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是ABDF.
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较低
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
| A. | AgCl、Ag2C2O4、AgI三者的饱和溶液中c(Ag+)大小顺序:Ag2C2O4>AgCl>AgI | |
| B. | 将0.02mol•L-1AgNO3溶液和0.02mol•L-1Na2SO4溶液等体积混合,有沉淀生成 | |
| C. | 向5mL饱和AgCl溶液中滴加0.5mL0.1mol•L-1KI溶液,无沉淀生成 | |
| D. | 向浓度均为0.1mol•L-1的NaCl和KI混合溶液中滴加AgNO3溶液,先有白色沉淀生成 |
| A. | 向无水乙醇中加入浓H2SO4,加热至170℃,将产生的气体通入酸性KMnO4溶液中紫红色褪去,使溶液褪色的气体一定是乙烯 | |
| B. | 苯酚钠溶液中通入少量二氧化碳得到苯酚和碳酸钠溶液 | |
| C. | 正丁烷的所有碳原子都在同一条直线上 | |
| D. | 实验室可用电石与饱和食盐水反应制取乙炔气体 |
 ;
;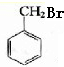 +H2O、
+H2O、 、
、 .
.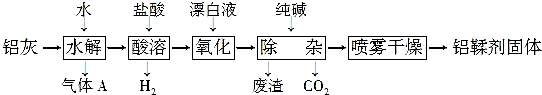

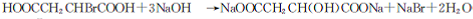 .
. +(n-1)H2O→n HOOCCH2CH(OH)COOH.
+(n-1)H2O→n HOOCCH2CH(OH)COOH.