题目内容
11.在Fe2(SO4)3和CuSO4的混合溶液中加入铁和铜的混合物,用玻璃棒搅拌使之充分反应.不考虑阴离子,从“Fe3+、Fe2+、Cu2+、Fe、Cu”中选择合适的符号填写:(1)若有固体剩余,且加盐酸后产生氢气,则剩余固体有Fe、Cu;溶液中没有Fe3+ Cu2+离子.
(2)若向反应后溶液中滴加KSCN,溶液变红色,则无可能固体剩余(填“有”或“不”);溶液中有Fe3+、Fe2+、Cu2+ 离子.
(3)若只有铜粉剩余,则溶液中肯定有Fe2+离子;Cu2+ 离子有可能存在.
分析 混合溶液中阳离子氧化性顺序,Fe3+>Cu2+;金属还原性Fe>Cu;氧化还原反应顺序进行,
Fe+2Fe3+=3Fe2+,Fe+Cu2+=Cu+Fe2+,2Fe3++Cu=2Fe2++Cu2+,铁离子遇到硫氰酸钾溶液呈红色,以此解答该题.
解答 解:(1)若有固体剩余,且加盐酸后产生氢气,说明剩余Fe,铜不反应,Fe+2Fe3+=3Fe2+,则剩余固体有Fe Cu,溶液中一定不存在Fe3+ Cu2+;
故答案为:Fe、Cu;Fe3+ Cu2+;
(2)若向反应后溶液中滴加KSCN,溶液变红色,说明含有Fe3+,反应有Fe+2Fe3+=3Fe2+,2Fe3++Cu=2Fe2++Cu2+,则一定不存在Fe、Cu,溶液中存在的离子为Fe3+ Cu2+ Fe2+;
故答案为:无;Fe3+、Fe2+、Cu2+;
(3)若只有铜粉剩余,反应为Fe+2Fe3+=3Fe2+或2Fe3++Cu=2Fe2++Cu2+,则溶液中肯定有Fe2+,Cu2+可能含有;
故答案为:Fe2+;Cu2+.
点评 本题综合考查元素化合物知识,侧重考查铁及其化合物性质的方向判断,氧化还原反应顺序进行的理解应用,为高频考点,注意把握物质的性质以及氧化性、还原性的判断,题目难度中等.

练习册系列答案
相关题目
1.下列条件下,两种气体分子数一定不相等的是( )
| A. | 相同质量、不同密度的N2O和CO2 | |
| B. | 相同体积、相同密度的N2和C2H4 | |
| C. | 相同温度、相同压强、相同体积的NO2和N2O4 | |
| D. | 相同压强、相同体积、相同质量的O2和O3 |
19.下列说法正确的是( )
| A. | 能自发进行的反应一定能迅速发生 | |
| B. | 反应NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1能自发进行,是因为体系有自发地向混乱度增大的方向转变的倾向 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为判断反应能否自发进行的判据 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
16.下列离子方程式中,正确的是( )
| A. | 铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+ | |
| B. | 大理石与稀盐酸反应:CO32-+2H+=CO2↑+H2O | |
| C. | 铜与稀硫酸反应:Cu+2H+=Cu2++H2↑ | |
| D. | 氯气与氢氧化钠溶液反应:Cl2+2OH-=Cl-+ClO-+H2O |
3.下列说法不正确的是( )
| A. | 苯和甲苯分子中所有原子均在同一平面上 | |
| B. | 苯不可以使KMnO4酸性溶液褪色而甲苯可以 | |
| C. | 苯和甲苯都能与卤素单质、硝酸等发生取代反应 | |
| D. | 苯的同系物的分子通式是CnH2n-6(n≥7) |
20.下列反应的离子方程式书写正确的是( )
| A. | 氯气溶于水:Cl2+H2O═Cl-+ClO-+2H+ | |
| B. | 金属钠加入稀硫酸中:Na+2H+═Na++H2↑ | |
| C. | 明矾溶液中加入足量Ba(OH)2溶液:SO42-+Al3++Ba2++4OH-═AlO2-+BaSO4↓+2H2O | |
| D. | 向含有稀盐酸的氯化亚铁溶液中通入氧气:4Fe2++O2+4H+═4 Fe3++2H2O |
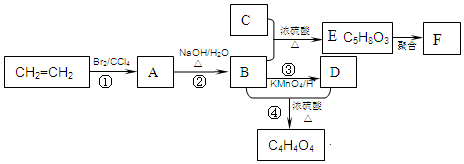
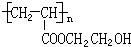 .
.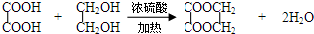 .
.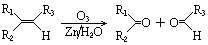

 本月4日,谷歌公司宣布:以60胜O负1平的战绩横扫众多围棋高手的神秘棋手“Master”乃是其人工智能产品AlpbaGo的升级版,人工智能再次成为热门话题.其中,高纯度硅是一种重要的基础材料.以下是工业上制取纯硅的一种方法:
本月4日,谷歌公司宣布:以60胜O负1平的战绩横扫众多围棋高手的神秘棋手“Master”乃是其人工智能产品AlpbaGo的升级版,人工智能再次成为热门话题.其中,高纯度硅是一种重要的基础材料.以下是工业上制取纯硅的一种方法: