题目内容
3.某兴趣小组用Fe3+与I-间的反应探究氧化还原反应规律与平衡移动原理的取系,回答下列问题:(1)用Fe2(SO4)3晶体配制100mL0.05mol/L的溶液,配制时需先把Fe2(SO4)3晶体溶解在较浓硫酸中,再用水稀释,加入硫酸的目的是Fe3++3H2O?Fe(OH)3+3H+,加入H2SO4可抑制Fe3+水解(结合化学用语回答).
(2)甲组同学将0.10mol/L的KI溶液和0.05mol•L-1 Fe2(SO4)3溶液各5mL混合充分反应后,溶液变为棕黄色,现进行如图1的实验①②.
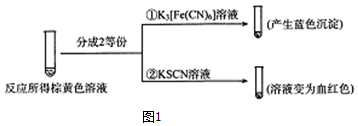
实验①中产生蓝色沉淀的离子方程式为3Fe2++2Fe(CN)63-=Fe3[Fe(CN)6]2↓,根据以上反应现象写出甲组同学实验中的离了方视式2Fe3++2I-?2Fe2++I2,在甲组同学的反应中,I2和Fe3+的氧化性强弱顺序为Fe3+>I2.
查阅资料:其它条件相同时,物质的氧化性及还原性强弱随浓度大小发生变化.
(3)乙组同学以图2的实验装置进一步探究上述反应,
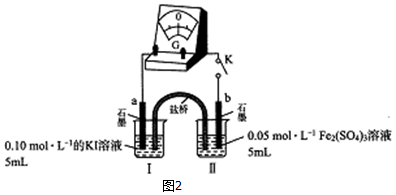
K闭合时,指针发生偏转,盐桥中的阳离子向b极(填“a”或“b”)定向移动;当指针归零时,向烧杯I中满加0.01mol/L AgNO3溶液,指针反向偏转,表明平衡发生了移动.据此分析I-还原性强弱与浓度关系I-浓度越小其还原性越弱.
(4)丙组同学欲测定甲组同学所得棕黄色溶液中c(I2),已知I2+2Na2S2O3=2NaI+Na2S4O6.现借助酸碱中和滴定相关仪器,用cmol•L-1的Na2S2O3溶液在弱碱性环境下对该溶液进行滴定,消耗Na2S2O3溶液VmL.
①Na2S2O3溶液装入碱式(填“酸式”或“碱式”)滴定管,选用淀粉济液为指示钊,滴定终点现象为最后一滴标液加入时溶液由蓝色褪去且30s不复原.
②老师提出丙组同学方案不可行,原因一是Fe3+可能氧化Na2S2O3,二是(滴定过程中I2被消耗,I2氧化性减弱)I-将会继续被氧化为I2,导致测定I2的真实浓度不准确.
分析 (1)铁离子水解,加入硫酸抑制其水解;
(2)亚铁离子与铁氰化钾反应生成Fe3[Fe(CN)6]2蓝色沉淀,0.10mol/L的KI溶液和0.05mol•L-1 Fe2(SO4)3溶液各5mL反应完全生成亚铁离子机和碘单质,由现象可知,有铁离子存在,即该反应为可逆反应,据此书写,氧化剂的氧化性强于氧化产物的氧化性;
(3)K闭合时,指针偏转,形成原电池,阳离子移向正极,正极发生还原反应为铁离子生成亚铁离子,为b极;当指针归零(反应达到平衡)后,向烧杯I中中滴加0.01mol/L AgNO3溶液,生成AgI黄色沉淀,可知I-浓度降低,2Fe3++2I-?2Fe2++I2平衡逆向移动;
(4)①Na2S2O3为强碱弱酸盐,溶液显碱性;淀粉做指示剂,Na2S2O3将碘还原为碘离子,溶液蓝色消失;
②溶液中的铁离子将碘离子氧化为碘单质.
解答 解:(1)铁离子水解,Fe3++3H2O?Fe(OH)3+3H+,加入H2SO4可抑制Fe3+水解;
故答案为:Fe3++3H2O?Fe(OH)3+3H+,加入H2SO4可抑制Fe3+水解;
(2)亚铁离子与铁氰化钾反应生成Fe3[Fe(CN)6]2蓝色沉淀,反应为:3Fe2++2Fe(CN)63-=Fe3[Fe(CN)6]2↓;0.10mol/L的KI溶液和0.05mol•L-1 Fe2(SO4)3溶液各5mL反应完全生成亚铁离子机和碘单质,由现象可知,有铁离子存在,则离子反应为:2Fe3++2I-?2Fe2++I2; 因为氧化剂的氧化性强于氧化产物的氧化性,故氧化性:Fe3+>I2;
故答案为:3Fe2++2Fe(CN)63-=Fe3[Fe(CN)6]2↓;2Fe3++2I-?2Fe2++I2;Fe3+>I2;
(3)K闭合时,指针偏转,形成原电池,阳离子移向正极,正极发生还原反应为铁离子生成亚铁离子,为b极;当指针归零(反应达到平衡)后,向烧杯I中中滴加0.01mol/L AgNO3溶液,生成黄色AgI沉淀,I-浓度降低,2Fe3++2I-?2Fe2++I2平衡逆向移动,指针反向偏转,说明I-浓度越小其还原性越弱;
故答案为:b;I-浓度越小其还原性越弱;
(4)①Na2S2O3为强碱弱酸盐,溶液显碱性,放碱式滴定管;Na2S2O3将碘还原为碘离子,终点时,溶液蓝色退去,且30s不恢复;
故答案为:碱式;最后一滴标液加入时溶液由蓝色褪去且30s不复原;
②丙组同学方案不可行,原因一是Fe3+可能氧化Na2S2O3,原因二是(滴定过程中I2被消耗,I2氧化性减弱)I-将会继续被氧化为I2,导致测定I2的真实浓度不准确;
故答案为:(滴定过程中I2被消耗,I2氧化性减弱)I-将会继续被氧化为I2,导致测定I2的真实浓度不准确.
点评 本题考查了原电池、氧化还原反应及平衡移动以及实验设计的综合考查,把握平衡移动的影响因素及物质的性质为解答的关键,对分析与实验能力要求较高,题目难度较大.

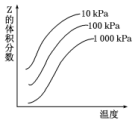 如图是温度和压强对反应X+Y?2Z影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )
如图是温度和压强对反应X+Y?2Z影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )| A. | 恒容时,混合气体的密度可作为此反应是否达到化学平衡状态的判断依据 | |
| B. | X、Y、Z均为气态 | |
| C. | 上述反应的逆反应的△H>0 | |
| D. | 使用催化剂Z的产率提高 |
| 实验 序号 | 反应温 度/℃ | Na2S2O3溶液 | 稀硫酸 | H2O | ||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
(2)下列有关该实验的叙述正确的是A(填字母).
A.实验前,应先用黑墨水笔在白纸上画粗浅一致的“+”字,衬在锥形瓶底部,实验中记录反应开始到产生的浑浊将锥形瓶底部的“+”字刚好完全遮盖所需的时间
B.该实验所需的计量仪器有量筒、温度计
C.实验时,应先将量取的Na2S2O3和H2SO4溶液混合,然后置于相应温度的热水浴中反应,记录每组反应所需时间
(3)实验过程中为什么不用测量一定时间内放出SO2气体的量来表示该反应的化学反应速率的大小?SO2易溶于水,无法准确测量其体积.
Ⅱ.已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图2所示.
(4)25.0℃时,0~6min氨基甲酸铵水解反应的平均速率为0.05mol/(L•min).
(5)根据图中信息,如何说明该水解反应的速率随温度升高而增大:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.10 | 0.10 | 0.09 |
| ② | 800 | 0.20 | 0.20 | 0.10 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
| A. | 实验①中,若5min时测得n(M)=0.05mol,则0至5min时间内,用N表示的平均反应速率v(N)=0.01 mol/( L•min) | |
| B. | 实验②中,该反应的平衡常数K=1.0 | |
| C. | 实验③中,达到平衡时,X的转化率为60% | |
| D. | 实验④中,达到平衡时,b>0.06 |
| A. | 石英砂可用于生产单晶硅 | |
| B. | 大多数金属在常温下是固体 | |
| C. | 可用氢氟酸在玻璃器皿上刻蚀标记 | |
| D. | 飞机机身的复合材料大多是以金属为增强体、纤维为基体的复合材料 |
| A. | 即将发射的嫦娥五号卫星使用的碳纤维是一种新型无机非金属材料 | |
| B. | 我国古代闻名于世界的化学工艺有烧陶瓷、造纸、冶金、制火药等 | |
| C. | 夏天雷雨过后感觉到空气清新是因为空气中产生了少量的氮氧化物 | |
| D. | 绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 |
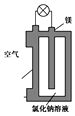 镁与锂相比有多种优点,比如锂的熔点约为180摄氏度,而镁的熔点高达约650摄氏度,因而更为安全,镁的蕴藏量也比锂丰富得多.图是镁燃料电池的一种原理图,该装置为圆筒状,其中心为镁柱,圆筒为可透气的导电材料.下列有关该镁燃料电池的叙述正确的是( )
镁与锂相比有多种优点,比如锂的熔点约为180摄氏度,而镁的熔点高达约650摄氏度,因而更为安全,镁的蕴藏量也比锂丰富得多.图是镁燃料电池的一种原理图,该装置为圆筒状,其中心为镁柱,圆筒为可透气的导电材料.下列有关该镁燃料电池的叙述正确的是( )| A. | 圆筒为正极,电极反应式为O2+4e-═2O2- | |
| B. | 该电池的总反应为2Mg+O2+2H2O═2Mg(OH)2 | |
| C. | Cl-在阳极失去电子生成Cl2 | |
| D. | 在反应过程中消耗24g的镁,同时消耗空气的体积大约为11.2L(标准状况) |
| A. | 现需80 mL 1.0 mol•L-1 NaOH溶液,称取3.2 g NaOH固体配制溶液浓度偏小 | |
| B. | 装标准液的滴定管未润洗,测得待测液的浓度偏大 | |
| C. | 用pH试纸测得新制氯水的pH为2 | |
| D. | 用酸式滴定管准确量取10.00mLKMnO4溶液 |
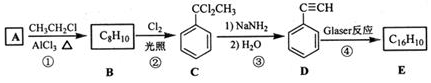
 .
. .
.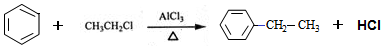 .
. )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为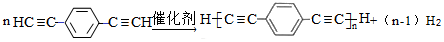 .
.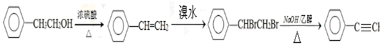 .
.