题目内容
化学反应原理在科研和生产中有广泛应用.
(1)SO2可用于制硫酸.已知25℃、101kPa时:
2SO2(g)+O2(g)═2SO3(g)△H1=-197kJ/mol;
H2O(g)═H2O(l)△H2=-44kJ/mol;
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJ/mol.
则SO3(g)与H2O(l)反应的热化学方程式是 .
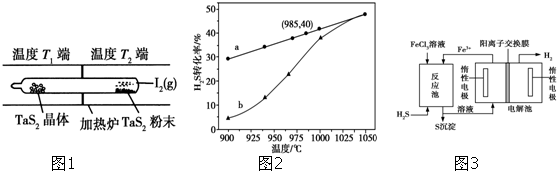
(2)利用“化学蒸气转移法”制备二硫化钽(TaS2)晶体,发生如下反应:TaS2(s)+2I2(g)═TaI4(g)+S2(g)△H>0 (Ⅰ),若反应(Ⅰ)的平衡常数K=1,向某恒容容器中加入1mol I2 (g)和足量TaS2(s),I2 (g)的平衡转化率为 .
如图1所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2 (g),一段时间后,在温度为T1的一端得到了纯净TaS2晶体,则温度T1 T2(填“>”“<”或“=”).上述反应体系中循环使用的物质是 .
(3)利用H2S废气制取氢气的方法有多种.
①高温热分解法,已知:H2S(g)═H2(g)+
S2(g)△H4
在恒容密闭容器中,控制不同温度进行H2S分解实验.以H2S起始浓度均为c mol?L-1测定H2S的转化率,结果见图2.图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.△H4 0(填>,=或<);说明随温度的升高,曲线b向曲线a逼近的原因: .
②电化学法
该法制氢过程的示意图如图3.反应池中反应物的流向采用气、液逆流方式,其目的是 ;
反应后的溶液进入电解池,电解总反应的离子方程式为 .
(1)SO2可用于制硫酸.已知25℃、101kPa时:
2SO2(g)+O2(g)═2SO3(g)△H1=-197kJ/mol;
H2O(g)═H2O(l)△H2=-44kJ/mol;
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJ/mol.
则SO3(g)与H2O(l)反应的热化学方程式是
(2)利用“化学蒸气转移法”制备二硫化钽(TaS2)晶体,发生如下反应:TaS2(s)+2I2(g)═TaI4(g)+S2(g)△H>0 (Ⅰ),若反应(Ⅰ)的平衡常数K=1,向某恒容容器中加入1mol I2 (g)和足量TaS2(s),I2 (g)的平衡转化率为
如图1所示,反应(Ⅰ)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2 (g),一段时间后,在温度为T1的一端得到了纯净TaS2晶体,则温度T1
(3)利用H2S废气制取氢气的方法有多种.
①高温热分解法,已知:H2S(g)═H2(g)+
| 1 |
| 2 |
在恒容密闭容器中,控制不同温度进行H2S分解实验.以H2S起始浓度均为c mol?L-1测定H2S的转化率,结果见图2.图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率.△H4
②电化学法
该法制氢过程的示意图如图3.反应池中反应物的流向采用气、液逆流方式,其目的是
反应后的溶液进入电解池,电解总反应的离子方程式为

考点:化学平衡的计算,用盖斯定律进行有关反应热的计算,化学平衡的影响因素,电解原理
专题:
分析:(1)利用盖斯定律,将热化学方程式进行运算;
(2)通过题意求出平衡浓度,带入K值可以得出转化率;
通过题意温度T2端利于反应正向进行,为高温,温度T1端利于反应向左进行,为低温,所以T1<T2;
(3)①由图象随着温度升高,H2S的转化率也随之增大,所以升高温度平衡向正反应方向移动,所以△H4>0;温度的升高,曲线b向曲线a逼近,反应速率加快;
②反应池中反应物的流向采用气、液逆流方式,可增大反应物接触面积;电解池中亚铁离子失去电子,氢离子得到电子,以此来解答.
(2)通过题意求出平衡浓度,带入K值可以得出转化率;
通过题意温度T2端利于反应正向进行,为高温,温度T1端利于反应向左进行,为低温,所以T1<T2;
(3)①由图象随着温度升高,H2S的转化率也随之增大,所以升高温度平衡向正反应方向移动,所以△H4>0;温度的升高,曲线b向曲线a逼近,反应速率加快;
②反应池中反应物的流向采用气、液逆流方式,可增大反应物接触面积;电解池中亚铁离子失去电子,氢离子得到电子,以此来解答.
解答:
解:(1)2SO2(g)+O2(g)?2SO3(g)△H1=一197kJ/mol ①
2H2O (g)=2H2O(1)△H2=一44kJ/mol ②
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol③
利用盖斯定律:(③-①-②)÷2 得SO3 (g)+H2O(l)=H2SO4(l)△H=-152kJ/mol,
故答案为:SO3 (g)+H2O(l)=H2SO4(l)△H=-152kJ/mol;
(2)K=1,设 I2的平衡转化率为x,则参加反应的为xmol,平衡时生成TaI4和S2各0.5xmol,剩余I2为(1-x)mol,
根据K=
=
=1,
解之得:x=66.7%,
故答案为:66.7%;
由所给方程式可知该反应为吸热反应,通过题意温度T2端利于反应正向进行,为高温,温度T1端利于反应向左进行,为低温,所以T1<T2,I2是可以循环使用的物质;
故答案为:<;I2;
(3)①以H2S起始浓度均为cmol?L-1测定H2S的转化率,由图象随着温度升高,H2S的转化率也随之增大,所以升高温度平衡向正反应方向移动,所以△H4>0;温度的升高,曲线b向曲线a逼近,反应速率加快,达到平衡时的时间缩短,
故答案为:>;温度升高,反应速率加快,达到平衡所需的进间缩短;
②反应池中反应物的流向采用气、液逆流方式,可增大反应物接触面积;电解池中亚铁离子失去电子,氢离子得到电子,电解总反应的离子方程式为2Fe2++2H+
2Fe3++H2↑,故答案为:增大反应物接触面积,使反应更充分;2Fe2++2H+
2Fe3++H2↑.
2H2O (g)=2H2O(1)△H2=一44kJ/mol ②
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l)△H3=一545kJ/mol③
利用盖斯定律:(③-①-②)÷2 得SO3 (g)+H2O(l)=H2SO4(l)△H=-152kJ/mol,
故答案为:SO3 (g)+H2O(l)=H2SO4(l)△H=-152kJ/mol;
(2)K=1,设 I2的平衡转化率为x,则参加反应的为xmol,平衡时生成TaI4和S2各0.5xmol,剩余I2为(1-x)mol,
根据K=
| c(TaI 4)c(S 2) |
| c 2(I 2) |
| 0.5x×0.5x |
| (1-x)2 |
解之得:x=66.7%,
故答案为:66.7%;
由所给方程式可知该反应为吸热反应,通过题意温度T2端利于反应正向进行,为高温,温度T1端利于反应向左进行,为低温,所以T1<T2,I2是可以循环使用的物质;
故答案为:<;I2;
(3)①以H2S起始浓度均为cmol?L-1测定H2S的转化率,由图象随着温度升高,H2S的转化率也随之增大,所以升高温度平衡向正反应方向移动,所以△H4>0;温度的升高,曲线b向曲线a逼近,反应速率加快,达到平衡时的时间缩短,
故答案为:>;温度升高,反应速率加快,达到平衡所需的进间缩短;
②反应池中反应物的流向采用气、液逆流方式,可增大反应物接触面积;电解池中亚铁离子失去电子,氢离子得到电子,电解总反应的离子方程式为2Fe2++2H+
| ||
| ||
点评:本题主要考查了盖斯定律及其以硫化氢为载体考查物质的性质、影响反应速率的因素、化学平衡、电化学等,题目综合性强,难度较大,注重了高考常考考点的考查,注意知识的迁移应用和信息的处理.

练习册系列答案
相关题目
下列现象中,能用范德华力解释的是( )
| A、氮气的化学性质稳定 |
| B、通常状况下,溴呈液态,碘呈固态 |
| C、水的沸点比硫化氢高 |
| D、锂的熔点比钠高 |
物质在化学反应前后,可能发生变化的是( )
| A、原子总数 | B、质子总数 |
| C、电子总数 | D、分子总数 |
部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:下列说法正确的是( )


| A、滤液A中的阳离子为Fe2+、Fe3+、H+ |
| B、样品中Fe元素的质量为1.12 g |
| C、样品中CuO的质量为4.0 g |
| D、V=448 |
与CO分子含有相同电子数的分子是( )
| A、HCl |
| B、N2 |
| C、H2O |
| D、CO2 |