题目内容
9.下列关于钠及其化合物的说法中,不正确的是( )| A. | 实验后剩余的钠粒,需要放回原试剂瓶中 | |
| B. | 少量的钠可以保存煤油中,如果露置在空气中会迅速和氧气反应生成过氧化钠 | |
| C. | 钠长期放罝在空气中,最终将变成碳酸钠 | |
| D. | 当钠与硫酸铜溶液反应时,有大量蓝色沉淀出现 |
分析 A.钠性质活泼,易与氧气、水反应;
B.钠性质比较活泼,能和氧气、水反应,所以保存钠时要隔绝空气和水;
C.钠放置于空气中发生银白色(钠的真面目)→变暗(生成Na2O)→变白色固体(生成NaOH)→成液(NaOH潮解)→结块(吸收CO2成Na2CO3•10H2O)→最后变成Na2CO3粉(风化);
D.钠投入硫酸铜溶液中时,先和水反应生成NaOH和氢气,生成的NaOH再和硫酸铜反应生成氢氧化铜蓝色沉淀.
解答 解:A.因钠活泼,易与水、氧气反应,如在实验室随意丢弃,可引起火灾,实验时剩余的钠粒可放回原试剂瓶中,故A正确;
B.钠性质比较活泼,能和氧气、水反应,所以保存钠时要隔绝空气和水,少量的钠可以保存在与钠不反应的煤油中,但露置在空气中会迅速和氧气反应生成氧化钠,故B错误;
C.钠放置于空气中发生银白色(钠的真面目)→变暗(生成Na2O)→变白色固体(生成NaOH)→成液(NaOH潮解)→结块(吸收CO2成Na2CO3•10H2O)→最后变成Na2CO3粉(风化),有关反应如下:4Na+O2=2Na2O、Na2O+H2O=2NaOH、2NaOH+CO2=Na2CO3+H2O、Na2CO3+10H2O=Na2CO3•10H2O、Na2CO3•10H2O=Na2CO3+10H2O,所以最终生成碳酸钠,故C正确;
D.钠投入硫酸铜溶液中时,先和水反应生成NaOH和氢气,生成的NaOH再和硫酸铜反应生成氢氧化铜蓝色沉淀,故D正确;
故选B.
点评 本题考查钠的性质,为高频考点,明确元素化合物性质及物质之间的反应是解本题关键,知道B中钠在空气中发生的一系列反应,注意D中反应先后顺序,题目难度不大.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案
相关题目
20.下列关于有机物的说法正确的是( )
①C3H6和C2H4的最简式相同且分子量相差14,所以是同系物
②乙二醇和甲醇含有相同的官能团,所以是同系物
③由乙烯生成乙醇属于加成反应
④苯酚、乙酸乙酯、甲醛的沸点逐渐变低.
①C3H6和C2H4的最简式相同且分子量相差14,所以是同系物
②乙二醇和甲醇含有相同的官能团,所以是同系物
③由乙烯生成乙醇属于加成反应
④苯酚、乙酸乙酯、甲醛的沸点逐渐变低.
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
17.以下对影响反应方向的因素的判断错误的是( )
| A. | 有时焓变起决定性作用 | |
| B. | 有时熵变起决定性作用 | |
| C. | 焓变和熵变是两个主要因素 | |
| D. | 温度不可能对反应方向起决定性作用 |
4.下列关于胶体的认识错误的是( )
| A. | 河流三角洲的形成与胶体的性质无关 | |
| B. | 清晨在密林中看到的一缕缕光束,是丁达尔现象的表现 | |
| C. | 向沸水中逐滴加入FeCl3溶液并加热至液体呈透明的红褐色,可得氢氧化铁胶体 | |
| D. | 胶体粒子的直径大小在1~100nm之间 |
14.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的是( )
| A. | 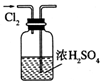 干燥C12 | B. | 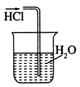 吸收HCl | ||
| C. | 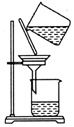 除去粗盐中的不溶物 | D. | 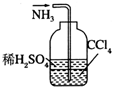 吸收NH3 |
1.下列类比关系正确的是( )
| A. | Na2O2与CO2反应生成Na2CO3和O2,则Na2O2与SO2反应可生成Na2SO3和O2 | |
| B. | Fe与Cl2反应生成FeCl3,则Fe与I2反应可生成FeI3 | |
| C. | 钠与氧气在不同条件下反应会生成两种不同的氧化物,则Li与氧气反应也能生成Li2O或Li2O2 | |
| D. | Al与Fe2O3能发生铝热反应,则Al与MnO2也能发生铝热反应 |
18.下列关于氯水的叙述正确的是( )
| A. | 新制氯水可使蓝色石蕊试纸先变红后褪色 | |
| B. | 光照氯水有气泡放出,该气体是Cl2 | |
| C. | 新制氯水中只含Cl2和H2O分子 | |
| D. | 氯水放置数天后酸性将变弱 |
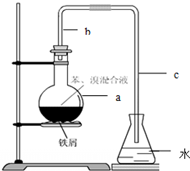
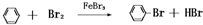 .
.