题目内容
9.CO2和H2可用于合成甲醇和甲醚.(1)已知①CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-725.5kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
③H2O(g)═H2O(l)△H=-44kJ•mol-1
则工业上以CO2(g)、H2(g)为原料合成CH3OH(l),同时生成H2O(l)的热化学方程式为CO2(g)+3H2(g)═CH3OH(l)+H2O(l)△H=-131.9kJ•mol-1.
(2)将CO2转化为甲醚的反应原理为2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(l)
已知在投料比n(CO2):n(H2)=1:3的条件下,不同温度、不同压强时,CO2的转化率见表:
| 温度 转化率 压强 | 500K | 600K |
| P | 60% | b |
| 1.5P | a | 55% |
A.在恒温、恒容的密闭容器中,当反应混合气体的密度保持不变时反应达平衡状态
B.当v正(CO2)=3v逆(H2),反应达平衡状态
C.当n(CO2):n(H2)=1:3时,反应达平衡状态
D.a>60%
②上述反应的化学平衡常数的表达式为K=$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}).{c}^{6}({H}_{2})}$.
③该反应的△H<0,原因是由表中数据可判断b<55%,可得温度升高,反应物转化率降低,所以正反应放热.
④在压强为P、温度为500K、投料比n(CO2):n(H2)=1:3的条件下,反应达平衡状态时H2的转化率为60%,混合气体中CO2的体积分数为$\frac{4}{19}$.
(3)以甲醇、空气、KOH溶液为原料可设计成燃料电池:放电时,负极的电极反应式为CH3OH-8e-+8OH-=CO32-+6H2O.
分析 (1)3×(②+③)-①,整理可得:CO2(g)+3H2(g)═CH3OH(l)+H2O(l)焓变进行相应的改变;(2)①A.反应前后改变的物理量不变时,可逆反应达到平衡状态;
B.当不同物质的反应速率方向相反且其速率之比等于计量数之比时,可逆反应达到平衡状态;
C.反应体系中各物质的物质的量不变时,可逆反应达到平衡状态;
D.该反应的正反应是一个反应前后气体体积减小的放热反应,降低温度、增大压强平衡正向移动;
②化学平衡常数是可逆反应达到平衡状态时各种生成物浓度幂之积与各种反应物浓度幂之积的比;
③恒容恒压条件下,升高温度平衡向吸热方向移动;
④在压强为P、温度为500K、投料比n(CO2):n(H2)=1:3的条件下,反应消耗的二者的物质的量的比是1:3,所以反应达平衡状态时H2的转化率为与CO2相同;
假设反应开始时加入CO2的物质的量是2mol,根据方程式2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(l)可知:每有2molCO2发生反应,会消耗H26mol,产生1mol CH3OCH3(g),现在CO2反应消耗的物质的量是△n(CO2)=1mol×0.6=0.6mol,消耗H2的物质的量是△n(H2)=3mol×0.6=1.8mol,产生CH3OCH3(g)的物质的量是:△n(CH3OCH3)=$\frac{1}{2}$△n(CO2)=0.3mol,平衡时混合气体中CO2的物质的量是n(CO2)=0.4mol,n(H2)=1.2mol;
(3)以甲醇、空气、KOH溶液为原料可设计成燃料电池,通入甲醇的电极为负极,放电时,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水.
解答 解:(1)3×(②+③)-①,整理可得:CO2(g)+3H2(g)═CH3OH(l)+H2O(l)△H=-131.9 kJ•mol-1;
故答案为:CO2(g)+3H2(g)═CH3OH(l)+H2O(l)△H=-131.9 kJ•mol-1;
(2)①A.在恒温、恒容的密闭容器中,反应前后气体减小、容器体积不变,所以密度减小,当容器内气体密度不变时,正逆反应速率相等,该反应达到平衡状态,故A正确;
B.当3v正(CO2)=v逆(H2)时该反应达到平衡状态,所以当v正(CO2)=v逆(H2)时该反应没有达到平衡状态,故B错误;
C.当n(CO2):n(H2)=1:3时,该反应可能达到平衡状态也可能没有达到平衡状态,与反应物物质的量及转化率有关,故C错误;
D.由于该反应的正反应是气体体积减小的反应,所以在压强不变时,增大压强,平衡向正反应方向移动,所以物质的转化率a>60%,故D正确;
故选AD;
②化学平衡常数是可逆反应达到平衡状态时各种生成物浓度幂之积与各种反应物浓度幂之积的比.该反应的化学平衡常数K=$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}).{c}^{6}({H}_{2})}$,
故答案为:K=$\frac{c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}).{c}^{6}({H}_{2})}$;
③在压强都是1.5 P时,在温度为500 K时,转化率a>60%,在600K时转化率是55%,说明升高温度,平衡逆向移动,逆反应方向为吸热反应,所以该反应的正反应为放热反应,所以△H<0,
故答案为:<;由表中数据可判断b<55%,可得温度升高,反应物转化率降低,所以正反应放热;
④在压强为P、温度为500K、投料比n(CO2):n(H2)=1:3的条件下,反应消耗的二者的物质的量的比是1:3,所以反应达平衡状态时H2的转化率为与CO2相同,为60%;
假设反应开始时加入CO2的物质的量是2mol,根据方程式2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(l)可知:每有2molCO2发生反应,会消耗H26mol,产生1mol CH3OCH3(g),现在CO2反应消耗的物质的量是△n(CO2)=1mol×0.6=0.6mol,消耗H2的物质的量是△n(H2)=3mol×0.6=1.8mol,产生CH3OCH3(g)的物质的量是:△n(CH3OCH3)=$\frac{1}{2}$△n(CO2)=0.3mol,平衡时混合气体中CO2的物质的量是n(CO2)=0.4mol,n(H2)=1.2mol,所以CO2体积分数为[0.4mol÷(0.4mol+1.2mol+0.3mol)]=$\frac{4}{19}$,
故答案为:60%;$\frac{4}{19}$;
(3)以甲醇、空气、KOH溶液为原料可设计成燃料电池,通入甲醇的电极为负极,放电时,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH-8e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-8e-+8OH-=CO32-+6H2O.
点评 本题考查较综合,涉及化学平衡计算、盖斯定律、原电池原理等知识点,侧重考查学生分析、计算能力,明确盖斯定律计算方法、化学平衡“三段式”、原电池电极反应式的书写方法是解本题关键,注意:只有反应前后改变的物理量才能作为化学平衡状态判断依据,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. |  干燥C12 | B. |  吸收HCl | ||
| C. |  除去粗盐中的不溶物 | D. |  吸收NH3 |
| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定没有乙烯 | ||
| C. | 混合气体中一定没有乙烷 | D. | 混合气体中可能含有C3H4 |
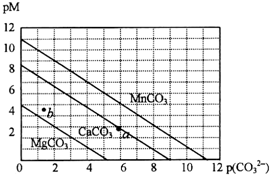 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示.已知:pM=-lg c(M),p(CO32-)=-lg c(CO32-).下列说法正确的是( )
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示.已知:pM=-lg c(M),p(CO32-)=-lg c(CO32-).下列说法正确的是( )| A. | M离子浓度越大,pM值越大 | |
| B. | MgCO3、CaCO3、MnCO3的Ksp依次增大 | |
| C. | b点表示MgCO3为不饱和溶液,若表示CaCO3则有沉淀析出 | |
| D. | a点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-) |
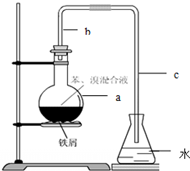
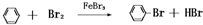 .
.

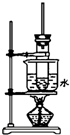 如图是实验室制取酚醛树脂的装置图(烧杯底部垫有石棉网).
如图是实验室制取酚醛树脂的装置图(烧杯底部垫有石棉网).