题目内容
13.如图所示是298K时N2与H2反应过程中,能量变化的曲线图.下列叙述正确的是( )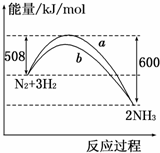
| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ/mol | |
| B. | a曲线是加入催化剂时的能量变化曲线 | |
| C. | 加入催化剂,该化学反应的反应热改变 | |
| D. | 在温度、体积一定的条件下,通入1mol N2和3mol H2反应后放出的热量为Q1kJ,若通入2mol N2和6mol H2反应后放出的热量为Q2kJ,则184>Q2>2Q1 |
分析 A、热化学方程式需要标注物质聚集状态和对应焓变;,选项中是反应的逆反应;
B、催化剂降低反应的活化能,改变反应速率不改变平衡;
C、催化剂只能降低正逆反应的活化能,对反应物和生成物的总能量无影响;
D、若通入2mol N2和6mol H2,则初始反应物的物质的量增大了一倍,由于压强增大平衡正向移动,所以反应的热量增大.
解答 解:A、该反应的热化学方程式为:N2 (g)+3H2(g)?2NH3 (g)△H=-92KJ/mol;故A错误;
B、催化剂降低反应的活化能,改变反应速率不改变平衡,a曲线是未加入催化剂时的能量变化曲线,b曲线是加入催化剂时的能量变化曲线,故B错误;
C、催化剂只能降低正逆反应的活化能,对反应物和生成物的总能量无影响,故对反应热无影响,故C错误;
D、向密闭容器中通入1mol N2和3mol H2,不可能完全转化,所以达到平衡时放出热量Q1kJ;另一容积相同的密闭容器中通入2mol N2和6mol H2,达到平衡时原平衡相同,则放出热量应该是2QkJ,通入2mol N2和6mol H2的压强比通入1mol N2和3mol H2的大了,平衡还会向正向移动,放出的热量还会增大,但由于是可逆反应,反应不能进行彻底,故184KJ>Q2,即184>Q2>2Q1,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的应用,主要是热化学方程式 书写,图象分析判断,反应能量变化,催化剂作用分析,题目难度中等.

练习册系列答案
相关题目
13.将少量铁粉加到过量的氯化铁溶液中,充分反应后,正确的结论是( )
| A. | 部分铁粉被氧化 | B. | 全部Fe3+被还原 | C. | 溶液质量减轻 | D. | 溶液质量增加 |
4.在新制的饱和氯水中,若改变某一条件,下列叙述正确的是( )
| A. | 再通入少量氯气,$\frac{c(O{H}^{-})}{c(HClO)}$减小 | |
| B. | 光照过程中,有气泡冒出,溶液的导电性减弱 | |
| C. | 加入少量的NaHSO3固体,pH增大,溶液漂白性增强 | |
| D. | 加入少量的NaHCO3固体,pH增大,溶液漂白性增强 |
8.下列表达方式错误的是( )
| A. |  | B. |  | C. | ${\;}_{8}^{18}$O | D. |  |
18.下列说法正确的是( )
| A. | 一定温度下,10mL 0.50mol•L-1NH4Cl溶液与20mL 0.25mol•L-1NH4C1溶液含NH4+物质的量相同 | |
| B. | 25℃时,将a mo1•L-l氨水与0.01 moI•L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| C. | 某酸式盐NaHA溶液中一定有:c(OH-)+c(A2-)=c(H+)+c(H2A) | |
| D. | 等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB |
5.下列实验现象与新制氯水中的某些成分(括号内物质)没有关系的是( )
| A. | 将NaHCO3固体加入新制氯水,有无色气泡(H+) | |
| B. | 使红色布条褪色(HCl) | |
| C. | 使淀粉KI试纸变蓝(Cl2) | |
| D. | 滴加AgNO3溶液生成白色沉淀(Cl-) |
2.用VSEPR模型预测下列分子或离子的立体结构,其中正确的是( )
| A. | H2O与BeCl2为角形(V形) | B. | CS2与SO2为直线形 | ||
| C. | BF3与PCl3为三角锥形 | D. | SO3与CO${\;}_{3}^{2-}$为平面三角形 |
3.Na2FeO4是一种高效多功能水处理剂,应用前景十分看好.一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是( )
| A. | Na2O2只作氧化剂 | |
| B. | 2 mo l FeSO4发生反应时,反应中共有8 mol电子转移 | |
| C. | FeSO4为还原剂 | |
| D. | 铁元素被还原,氧元素被氧化 |