题目内容
4.在新制的饱和氯水中,若改变某一条件,下列叙述正确的是( )| A. | 再通入少量氯气,$\frac{c(O{H}^{-})}{c(HClO)}$减小 | |
| B. | 光照过程中,有气泡冒出,溶液的导电性减弱 | |
| C. | 加入少量的NaHSO3固体,pH增大,溶液漂白性增强 | |
| D. | 加入少量的NaHCO3固体,pH增大,溶液漂白性增强 |
分析 A.氯气与水的反应,加入氯气,溶液为饱和溶液;
B.光照后次氯酸浓度减小,平衡Cl2+H2O?HCl+HClO向着正向移动,溶液中离子浓度增大,导电性增强;
C.加入亚硝酸钠后,氯气与亚硫酸氢钠反应,导致次氯酸浓度减小;
D.碳酸氢钠与盐酸反应消耗氢离子结合化学平衡移动原理解答.
解答 解:A.氯气溶于水达到平衡后,再通入少量氯气,此时已经为饱和溶液,浓度比值$\frac{c(O{H}^{-})}{c(HClO)}$不变,故A错误;
B.光照过程中HClO分解,使平衡Cl2+H2O?HCl+HClO向正向移动,导致溶液中离子浓度增大,溶液的导电性会增强,故B错误;
C.加入少量的NaHSO3固体,氯气与亚硫酸氢钠发生氧化还原反应,导致氯气浓度减小,溶液中次氯酸的浓度减小,溶液的漂白性减弱,故C错误;
D.加入少量的NaHCO3固体,HCl与碳酸氢钠反应,导致Cl2+H2O?HCl+HClO向正向移动,氢离子浓度减小,pH增大,次氯酸浓度增加,溶液漂白性增强,故D正确;
故选D.
点评 本题考查了氯气、氯水的性质,题目难度中等,明确化学平衡、电离平衡的影响因素为解答关键,试题侧重考查学生的分析、理解能力及灵活应用能力.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
4.自然环境与人们的生活息息相关.下列有关环境的说法不正确的是( )
| A. | 氟利昂(CCl2F2)因破坏大气臭氧层,会导致“温室效应” | |
| B. | 生活污水中所含的氮、磷化合物是植物营养素,但会导致水体污染 | |
| C. | 废旧电池的回收,其主要目的是为了保护环境 | |
| D. | 淀粉餐具被认为是最有发展前景的一次性餐具,可有利于保护环境 |
5.下列物质中,只能与NaOH溶液作用,不能与盐酸作用的是( )
| A. | KHSO4 | B. | (NH4)2CO3 | C. | NaHCO3 | D. | NH4HCO3 |
9.在沸腾炉中进行反应时,被氧化的元素是( )
| A. | 只有硫 | B. | 只有铁 | C. | 硫和铁 | D. | 硫和氧 |
9.在渔业生产中,有时需要异地运输鱼苗,为保证运输过程中鱼苗不死亡,必须满足下列条件:(1)水的pH要调在8~8.5之间;(2)防止细菌大量繁殖;(3)水中要溶有充足的氧气;(4)使鱼苗呼出的CO2气体及时排出.在长距离储运鱼苗的水中,最好加入下列物质中的( )
| A. | 纯净的氧气 | B. | 过氧化氢 | C. | 过氧化钠 | D. | 过氧化钙 |
16. 如图表示agO2与agX气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )
如图表示agO2与agX气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )
 如图表示agO2与agX气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )
如图表示agO2与agX气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )| A. | C2H4(气) | B. | CH4 | C. | CO2 | D. | NO |
13.如图所示是298K时N2与H2反应过程中,能量变化的曲线图.下列叙述正确的是( )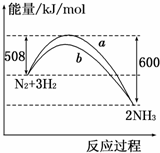

| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ/mol | |
| B. | a曲线是加入催化剂时的能量变化曲线 | |
| C. | 加入催化剂,该化学反应的反应热改变 | |
| D. | 在温度、体积一定的条件下,通入1mol N2和3mol H2反应后放出的热量为Q1kJ,若通入2mol N2和6mol H2反应后放出的热量为Q2kJ,则184>Q2>2Q1 |
