题目内容
3.Na2FeO4是一种高效多功能水处理剂,应用前景十分看好.一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是( )| A. | Na2O2只作氧化剂 | |
| B. | 2 mo l FeSO4发生反应时,反应中共有8 mol电子转移 | |
| C. | FeSO4为还原剂 | |
| D. | 铁元素被还原,氧元素被氧化 |
分析 该反应中Fe元素化合价由+2价变为+6价、O元素化合价由-1价变为0价、-2价,所以硫酸亚铁是还原剂、过氧化钠既是氧化剂又是还原剂,氧化剂对应的产物是还原产物,还原剂对应的产物是氧化产物,以此来解答.
解答 解:该反应中Fe元素化合价由+3价变为+6价、O元素化合价由-1价变为0价、-2价,所以硫酸亚铁是还原剂、过氧化钠既是氧化剂又是还原剂,
A.该反应中过氧化钠既作氧化剂又作还原剂,故A错误;
B.反应中化合价升高的元素有Fe,由+2价→+6价,化合价升高的元素还有O元素,由-1价→0价,2molFeSO4发生反应时,共有2mol×4+1mol×2=10mol电子转移,故B错误;
C.该反应中Fe元素化合价由+3价变为+6价,所以硫酸亚铁是还原剂,故C正确;
D.该反应中Fe元素化合价由+3价变为+6价、O元素化合价由-1价变为0价、-2价,Fe、O元素被氧化,同时O元素被还原,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意基本概念的分析,题目难度不大.

练习册系列答案
相关题目
13.如图所示是298K时N2与H2反应过程中,能量变化的曲线图.下列叙述正确的是( )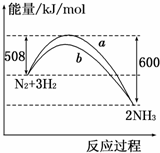

| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ/mol | |
| B. | a曲线是加入催化剂时的能量变化曲线 | |
| C. | 加入催化剂,该化学反应的反应热改变 | |
| D. | 在温度、体积一定的条件下,通入1mol N2和3mol H2反应后放出的热量为Q1kJ,若通入2mol N2和6mol H2反应后放出的热量为Q2kJ,则184>Q2>2Q1 |
11.2mol甲烷完全和氯气发生取代反应,生成四种取代产物的物质的量相同,则消耗氯气的物质的量为( )
| A. | 5mol | B. | 4mol | C. | 6mol | D. | 3.5mol |
18.下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是( )
| A. | NaAlO2和HNO3 | B. | AlCl3和KOH | C. | KHSO4和Ba(OH)2 | D. | K2CO3和HCl |
8.下列叙述中,不正确的是( )
| A. | C5H12的同分异构体中,其中的一种只能生成一种一氯代物 | |
| B. | CH3-CH﹦CH-C≡C-CF3分子结构中6个碳原子不可能都在同一平面上 | |
| C. |  不属于脂环化合物 不属于脂环化合物 | |
| D. |  和 和 不是同系物 不是同系物 |
15.人们已步入“4G”时代,以光导纤维为基础的高速信息通道尤为重要.制造光导纤维的材料是( )
| A. | 铜合金 | B. | 橡胶 | C. | 聚乙烯 | D. | 二氧化硅 |
12.下列实验方法正确的是( )
| A. | 要使AlCl3溶液中Al3+全部沉淀出来可使用氨水 | |
| B. | 某气体能使品红溶液褪色,该气体一定为SO2 | |
| C. | 用饱和NaHCO3溶液除去混在Cl2中的HCl气体 | |
| D. | 用Cl2除去Fe2(SO4)3溶液中的少量FeSO4 |
13.随着卤素原子序数递增,下列说法正确的是( )
| A. | 单质的熔、沸点逐渐降低 | B. | 单质的氧化性逐渐减弱 | ||
| C. | 阴离子的还原性逐渐减弱 | D. | 气态氢化物稳定性逐渐增强 |
