题目内容
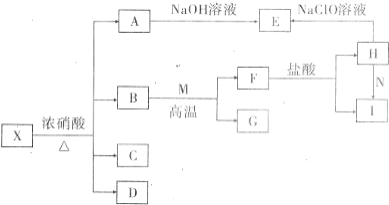 固体X是由两种常见元素组成的化合物.其中金属元素与另一元素的质量比为14:1.在一定条件下X可发生如下转化(部分产物未标出).C是无色无昧且能使澄清石灰水变浑浊的气体,D为红棕色气体,E为红褐色沉淀,M为常见金属单质.
固体X是由两种常见元素组成的化合物.其中金属元素与另一元素的质量比为14:1.在一定条件下X可发生如下转化(部分产物未标出).C是无色无昧且能使澄清石灰水变浑浊的气体,D为红棕色气体,E为红褐色沉淀,M为常见金属单质.请回答:
(1)X的化学式为
(2)实现H→I的转化,且不引进新的杂质:N可选择下列物质中的
①KMnO4 ②HNO3 ③H2O2 ④Cl2
(3)简述检验A溶液中金属阳离子的方法
(4)B和M反应的化学方程式为
(5)写出下列反应的离子方程式:
①F和盐酸的反应
②H→E的反应
(6)已知标准状况下D的密度约为2.05g?L-1.实验室测得D的密度常比理论值大,原因是
考点:无机物的推断
专题:
分析:分析流程可知,C是无色无昧且能使澄清石灰水变浑浊的气体,判断为CO2,D为红棕色气体为NO2,E为红褐色沉淀为Fe(OH)3,A溶液中含有铁离子为Fe(NO3)3,固体X是由两种常见元素组成的化合物,判断一定含有铁元素和碳元素,其中金属元素与另一元素的质量比为14:1.则X化学式为Fe3C,B为水H2O,则依据M为常见金属单质,生成F和盐酸反应生成H含有铁元素判断,M为金属Fe,F为Fe3O4,G为H2,H被次氯酸钠氧化证明为H为FeCl2,I为FeCl3,N为Cl2;
结合分析判断的物质分析回答问题.
结合分析判断的物质分析回答问题.
解答:
解:分析流程可知,C是无色无昧且能使澄清石灰水变浑浊的气体,判断为CO2,D为红棕色气体为NO2,E为红褐色沉淀为Fe(OH)3,A溶液中含有铁离子为Fe(NO3)3,固体X是由两种常见元素组成的化合物,判断一定含有铁元素和碳元素,其中金属元素与另一元素的质量比为14:1.则X化学式为Fe3C,B为水H2O,则依据M为常见金属单质,生成F和盐酸反应生成H含有铁元素判断,M为金属Fe,F为Fe3O4,G为H2,H被次氯酸钠氧化证明为H为FeCl2,I为FeCl3,N为氧化剂Cl2,过氧化氢;
(1)分析判断X为Fe3C,C为CO2,是共价化合物电子式为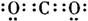 ;
;
故答案为:Fe3C;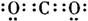 ;
;
(2)实现H→I的转化,是FeCl2变化为FeCl3,且不引进新的杂质,N可选择下列物质中的H2O2,Cl2,HNO3,会引入硝酸根离子杂质,KMnO4 会引入钾离子、锰离子杂质;
故答案为:③④;
(3)A溶液中金属阳离子为Fe3+,依据铁离子检验设计,取少量A溶液,滴加KSCN溶液,若出现红色说明存在铁离子,否则不存在;
故答案为:取少量A溶液,滴加KSCN溶液,若出现红色说明存在铁离子,否则不存在;
(4)B和M反应水铁和水蒸气的反应,反应的化学方程式为:3Fe+4H2O
Fe3O4+4H2;
故答案为:3Fe+4H2O
Fe3O4+4H2;
(5)①F和盐酸的反应是Fe3O4和盐酸反应生成氯化铁、氯化亚铁和水,反应的离子方程式为:Fe3O4+8H+=Fe2++2Fe3++4H2O;
故答案为:Fe3O4+8H+=Fe2++2Fe3++4H2O;
②H→E的反应为在碱溶液中Fe2+被次氯酸根离子氧化为铁离子生成氢氧化铁,反应的离子方程式为:2Fe2++ClO-+4OH-+H2O=2Fe(OH)3+Cl-;
故答案为:2Fe2++ClO-+4OH-+H2O=2Fe(OH)3+Cl-;
(6)已知标准状况下D为NO2,密度约为2.05g?L-1.实验室测得D的密度常比理论值大,是因为二氧化氮会转化为四氧化二氮,体积减小;
故答案为:NO2部分转化为N2O4 .
(1)分析判断X为Fe3C,C为CO2,是共价化合物电子式为
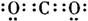 ;
;故答案为:Fe3C;
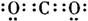 ;
;(2)实现H→I的转化,是FeCl2变化为FeCl3,且不引进新的杂质,N可选择下列物质中的H2O2,Cl2,HNO3,会引入硝酸根离子杂质,KMnO4 会引入钾离子、锰离子杂质;
故答案为:③④;
(3)A溶液中金属阳离子为Fe3+,依据铁离子检验设计,取少量A溶液,滴加KSCN溶液,若出现红色说明存在铁离子,否则不存在;
故答案为:取少量A溶液,滴加KSCN溶液,若出现红色说明存在铁离子,否则不存在;
(4)B和M反应水铁和水蒸气的反应,反应的化学方程式为:3Fe+4H2O
| ||
故答案为:3Fe+4H2O
| ||
(5)①F和盐酸的反应是Fe3O4和盐酸反应生成氯化铁、氯化亚铁和水,反应的离子方程式为:Fe3O4+8H+=Fe2++2Fe3++4H2O;
故答案为:Fe3O4+8H+=Fe2++2Fe3++4H2O;
②H→E的反应为在碱溶液中Fe2+被次氯酸根离子氧化为铁离子生成氢氧化铁,反应的离子方程式为:2Fe2++ClO-+4OH-+H2O=2Fe(OH)3+Cl-;
故答案为:2Fe2++ClO-+4OH-+H2O=2Fe(OH)3+Cl-;
(6)已知标准状况下D为NO2,密度约为2.05g?L-1.实验室测得D的密度常比理论值大,是因为二氧化氮会转化为四氧化二氮,体积减小;
故答案为:NO2部分转化为N2O4 .
点评:本题考查了物质转化关系,物质性质的分析判断,反应现象和物质性质是解题关键,题目难度中等.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案
相关题目
下列实验方法正确的是( )
| A、配制一定物质的量浓度的溶液时,若加水超过容量瓶的刻度线,用胶头滴管将多余液体吸出即可 |
| B、用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则溶液中一定不含有K+ |
| C、区别FeCl3溶液和Fe(OH)3胶体时,可将它们分别用一束光照射,看有无丁达尔效应出现 |
| D、检验某溶液中是否含有Fe3+时,可先加入适量的氯水,再滴加硫氰化钾溶液,若溶液变为红色,则说明溶液中一定含有Fe3+ |
下列离子方程式中正确的是( )
| A、向FeBr2溶液中通入过量氯气:2Fe2++Cl2=2Fe3++2Cl- |
| B、向稀硫酸加入少量Ba(OH)2溶液:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| C、碳酸氢铵溶液与足量的NaOH溶液共热,NH4++OH-?NH3↑+H2O |
| D、鸡蛋壳和醋酸溶液的主要反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
下列说法正的是( )
| A、1 mol 蔗糖可水解生成2 mol葡萄糖 |
| B、CH3-CH=CH-CH3与C3H6一定互为同系物 |
| C、C4H9Cl共有同分异构体9种 |
D、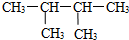 的名称是2,3-二甲基丁烷 的名称是2,3-二甲基丁烷 |
下列各物质若n值相等时,其可能饱和一元同类有机化合物的同分异构体最多的是( )
| A、CnH2nO2 |
| B、CnH2nO |
| C、CnH2n+2O2 |
| D、CnH2n+2 |
资源利用、环境保护等在与社会可持续发展密切相关的领域发挥着积极作用.下列做法与社会可持续发展理念相违背的是( )
| A、改进汽车尾气净化技术,减少大气污染物的排放 |
| B、过度开采矿物资源,促进地方经济发展 |
| C、开发利用新能源,减少化石燃料的使用 |
| D、加强对工业“三废”的治理,保护环境 |
下列说法正确的是( )
| A、用湿润的碘化钾淀粉试纸检验氯化氢气体中是否混有氯气 |
| B、次氯酸具有酸性,可与碳酸钠反应产生二氧化碳气体 |
| C、新制氯水的酸性一定比久置的氯水强 |
| D、干燥氯气能使有色布条褪色 |
下列事实中,能证明氯化氢是强电解质的是( )
| A、氯化氢易溶于水 |
| B、氯化氢水溶液能导电 |
| C、氯化氢在水溶液中完全电离 |
| D、氯化氢易挥发 |